شوینده ها دسته ای از ترکیبات شیمیایی هستند که به علت دارابودن همزمان آبدوستی و آبگریزی برای تمیزکاری استفاده می شوند. به سبب ساختار و فعالیت شیمیایی آن ها، شوینده ها می توانند به یک لکه روغنی پیوند شوند و با شستشو سبب جدا شدن لکه از سطح شوند.
شیمی شوینده ها مطالبی پایه ای است و با کمی تلاش می تواند برای همگان قابل فهم باشد.
فهرست مطالب
فهم ترکیب شیمیایی شوینده ها
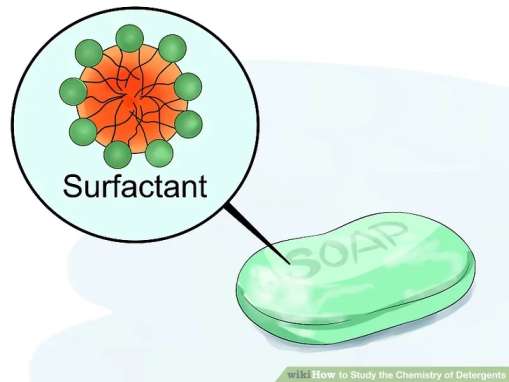
تعریف سورفکتانت ها
یک سورفکتانت ماده شیمیایی خاصی است که کشش سطحی آب را کاهش می دهد. حتما تشکیل قطرات مجزای آب را بر روی پنجره یا میز دیده اید.
علت تشکیل این قطرات به علت کشش سطحی آب است. اگر شما یک سورفکتانت اضافه کنید، آب کاملا پخش خواهد شد و تمامی سطح را خیس خواهد کرد.
- سورفکتانت ها می توانند بوسیله ی خواص یونیشان یا بار الکتریکی به صورت زیر دسته بندی شوند: آنیونی (دارای بار منفی)، کاتیونی (دارای بار مثبت)، غیر یونی (بدون بار الکتریکی) و آمفوتری (درای بارهای مثبت و منفی).
- صابون یک سورفکتانت آنیونی است در حالی که شوینده ها از یک یا چند نوع سوزفکتانت با بارهای متفاوت تشکیل می شوند.
- در ساده ترین تعریف، یک سورفکتنانت کشش سطحی را کاهش می دهد به طوری که آب تمام سطح (لباس و …) را خیس می کند. وقتیکه لباس به خوبی خیس شود، سورفکتانت آسانتر می تواند چرک و روغن را از بین ببرد.
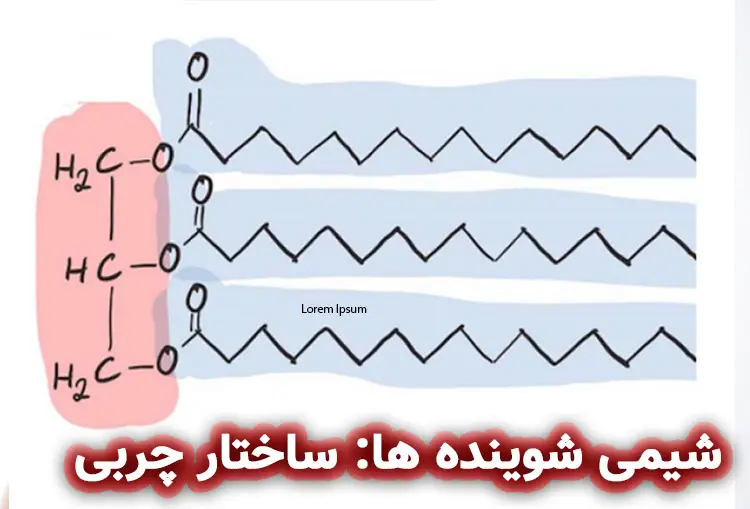
شیمی شوینده ها: آشنایی با ساختار چربی و روغن ها
شوینده ها از اسیدهای چرب و نمک های سدیم یا پتاسیم تشکیل شده اند. تری گلیسریدها ترکیبات مشتق از چربی های گیاهی یا حیوانی هستند و روغن ها از 3 اسید چرب و گلیسرین تشکیل شده اند.
- اسیدهای چرب متشکل از زنجیره هیدروکربنی متصل به یک گروه کربوکسیلیک اسیدهای ضعیف هستند. اسیدهای چرب به عنوان سورفکتانت در نظرگرفته می شوند به طوری که آن ها بر روی آب شناور می شوند و کشش سطحی آب را کاهش می دهند.
آشنای یا نمک های قلیایی

یک نمک قلیایی بخش بازی (pH > 7.0) قابل حل از یک فلز قلیایی همچون سدیم یا پتاسیم است. نمک های قلیایی قادرند با اسیدها واکنش دهند و آن ها را خنثی کنند. سدیم هیدروکسید و پتاسیم هیدروکسید دو نمونه از معمولیترین نمک ها مورد استفاده در صابون ها و شوینده ها هستند.
- نمک قلیایی به گروه کربوکسیلیک متصل می شود تا کربوکسیلات تشکیل دهد. تمام مولکول کربوکسیلات و اسید چرب به عنوان صابون شناخته می شود.
- این مواد شیمیایی بسیار سوزش آور هستند و در صورتی که به صورت ایمن از آن ها استفاده نشوند ممکن است سبب ایجاد سوختگی بر روی پوست بدن شوند.
- سدیم هیدروکسید برای ساخت صابون های جامد استفاده می شود در حالی که پتاسیم هیدروکسید برای تولید صابون های مایع استفاده می شود.
- در آب، نمک قلیایی نسبت به اسید چرب محلول تر است.
تعریف آبدوستی و آبگریزی
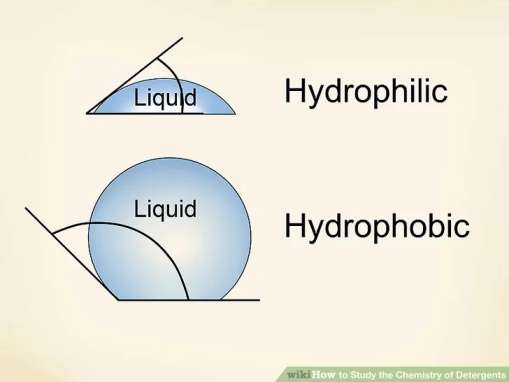
در شیمی، ترکیبات آبگریز تمایل به دوری از آب دارند و در آب حل نمی شوند. آبدوست ها ترکیبات عاشق آب هستند و در آب حل می شوند. صابون منحصر به فرد است و دارای دم آبگریز است که از زنجیره های بلند کربنی تشکیل شده است و سر آبدوست دارد که از کربوکسیلات ساخته شده است.
- دم آبگریز صابون قادر است به لکه هایی همچون گریس و روغن که آبگریز هستند پیوند شوند در حالی که سر آبدوست صابون جذب آب می شود و اجازه می دهد لکه ها با آب شسته شوند.
- شوینده های سنتزی زمانی که آب آب سخت(دارای نمک های معدنی) استفاده شود به علت وجود چندین نوع سورفکتانت عملکرد بهتری نسبت به صابون دارند.
آشنایی با شیمی شوینده ها

مواد لازم برای ساخت شوینده ها
برای ساخت یک شوینده، شما نیاز به چربی و سدیم هیدروکسید دارید. چربی ها می توانند از حیوانات یا گیاهان استخراج شوند. سدیم هیدروکسید که به عنوان قلیا شناخته می شود یک ترکیب ضروری برای ساخت صابون است.
- سدیم هیدروکسید یا قلیا بی نهایت سوزش آور است و باید به درستی از آن استفاده کرد. هنگام کار با قلیا نمام نکات ایمنی را باید در نظر داشته باشید و حتما از عینگ، دستکش و لباس آستین بلند و کفش سرپوشیده استفاده کنید.
مکان مناسب برای ساخت شوینده ها

چون قلیا ماده ای سوزش آور است، باید با احتیاط از آن استفاده کرد تا سبب ایجاد جراحت بر روی پوست نشود. هنگام ساخت یک شوینده، بچه ها و حیوانات خانگی را از محل دور کنید. در محیطی کار کنید که تهویه مناسبی داشته باشد. درها و پنجره های محل کار را باز کنید. چون قلیا از آب سنگین تر است همواره قلیا را به آب اضافه کنید. در صورتی که بر عکس عمل کنید به علت سبک تر بودن آب، آب بر روی قلیا قرار خواهد گرفت و چون واکنش آب و قلیا گرماده و شدید است ممکن است سبب پاشیدن قلیا به اطراف شود.
- در محلی که کار می کنید باید منبع آب وجود داشته باشد تا در صورت نیاز به سرعت بتوانید از آن استفاده کنید.
- در صورتی که قلیا در چشم شما ریخت حداقل برای 15 دقیقه باید صورت و چشم ها را زیر آب سرد بشویید تا از شسته شدن تمامی مواد شیمیایی اطمینان حاصل شود.
چربی و سدیم هیدروکسید را مخلوط کنید و گرما دهید

اولین گام ساخت شوینده صابونی شدن نام دارد. چربی و روغن ها حاوی زنجیره های اسید چرب هستند و وجود تری گلیسریدها برای شوینده ها ضروری هستند. زمان اختلاط سدیم هیدروکسید و چربی ها، مولکول های گلیسرین خارج می شود و سدیم هیدروکسید با کربوکسیلیک اسیدهای اسدی چرب ترکیب می شود.
- صابون حاصل یک کربوکسیلیک اسید طویل زنجیر است.
برای جداسازی گلیسرین نمک اضافه کنید

شوینده در آب نمک خیلی محلول نیست در حالی که گلیسرین به شدت در آب نمک محلول است.بیشتر گلیسرین به علت ارزش بالای آن جداسازی می شود و مقدار کمی از آن در صابون بجای می ماند تا صابون را نرم تر کند. وقتیکه نمک اضافه شد مخلوط به دو لایه جدا می شود: صابون خام و گلیسرین.
- صابون در بالا قرار می گیرد و گلیسرین ته نشین می شود.
- این فرایند معمولا چند بار تکرار می شود تا بیشتر گلیسرین جدا شود.
باز را با یک اسید ضعیف خنثی کنید
در این مرحله، صابون مانند قلیا سوزش آور نخواهد بود اما هنوز مناسب استفاده نیست. باز می تواند با ایتفاده از اسید ضعیف مانند سیتریک اسید یا فسفریک اسید خنثی شود. این اسید باقیمانده سدیم هیدروکسید را حنثی می کند و شوینده جهت استفاده ایمن می شود.
- بعد از خنثی سازی، صابون خشک می شود و سپس قابل استفاده خواهد بود.
دانش خود را در مورد شیمی شوینده ها عمیق تر کنید

از حافظه خود کمک بگیرید
مهمترین مفهومی که در رابطه با شیمی شوینده هاست این نکته است که شوینده ها هم سر آبدوست دارند و هم دم آبگریز. به منظور بخاطر سپردن این دو واژه به یاد داشته باشید که فوبیا (phobia) به معنای ترس از چیزی است. چون هیدرو (hydro) به معنای آب است، هیدروفوبیک (hydrophobic) به معنای ترس از آب یا همان آب گریزی است.
- اگر معنای هیدروفوب را به خاطر داشته باشید کافیت بدانید معنی هیدروفیلیک دقیا متضاد این واژه است یعنی آب دوست!
در مورد خواص شوینده های آنیونی و کاتیونی مطالعه کنید
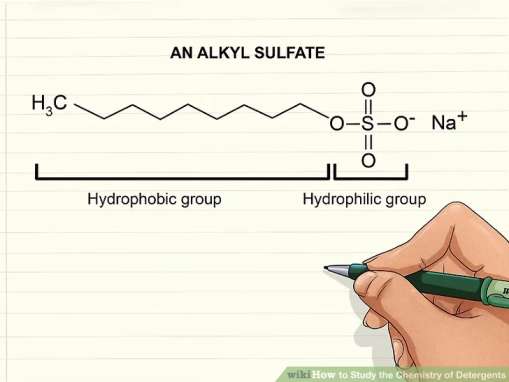
شوینده های آنیونی بار منفی بر روی سر آبدوست دارند در حالی که شوینده های کاتیونی در سر آبدوسن خود بار الکتریکی مثبت دارند. شوینده های کاتیونی قوی تر در نظر گرفته می شوند چرا که می توانند ساختارهای پروتیینی را اصلاح کنند. شوینده های کاتیونی نیز قادر به کشتن میکروب ها هستند و باقیمانده های شوینده های آنیونی را به خوبی خنثی می کنند.
- شوینده های آنیونی معمولا برای شستن کف ساختمان بکار می روند.
- شوینده های کاتیونی معمولا برای شستن لباس ها و در شامپوها کاربرد دارند.
صنعت چاپ و با استفاده از طراحان گرافیک است. چاپگرها و متون بلکه روزنامه و مجله در ستون و سطر آنچنان که لازم است.
خواص شوینده های غیر یونی را مطالعه کنید

شوینده های غیر یونی زیر گروهی از شوینده ها هستند که بار الکتریکی ندارند. به علت فقدان بار الکتریکی، با یون های سخت آب کواکنش نمی دهند و برای شستن لباس ها کمتر مفید هستند. شوینده های غیر یونی نیست به شوینده های یونی کمتر کف تولید می کنند.
- شوینده های غیر یونی معمولا به عنوان مایعات ظرفشویی یکار می روند.
در مطالبی که به زودی بر روی سایت منتشر خواهد شد بیشتر در مورد شیمی شوینده ها صحبت خواهیم کرد!
منبع: