💎 فهرست مطالب
در دنیای پیچیدهی شیمی، محلول ها جایگاه ویژهای دارند و به عنوان سنگ بنای بسیاری از فرآیندها و محصولات، بهویژه در صابون سازی، آرایشی و بهداشتی، عمل میکنند. از شفافیت یک شامپو تا قوام یک کرم یا قدرت پاک کنندگی یک شوینده، همگی ریشه در درک عمیق خواص و رفتارهای محلولها دارند. برای اعضای سامانهی نخبگان صابون ساز که همگی در کار ساخت صابون، محصولات آرایشی و بهداشتی و بعضاً انواع شوینده فعال هستند، تسلط بر مفاهیم محلول و انحلال پذیری نه تنها یک مزیت، بلکه یک ضرورت برای نوآوری، بهینهسازی فرآیندها و تضمین کیفیت محصول نهایی است. این مقاله به بررسی جامع محلولها، انواع آنها، پدیدهی انحلال و عوامل مؤثر بر آن، و همچنین تفاوتهای کلیدی آنها با کلوئیدها و سوسپانسیونها میپردازد تا دانش و بینش لازم را برای ارتقای تولیدات شما فراهم آورد.
محلول چیست؟ تعاریف و اهمیت آن در صنعت شما
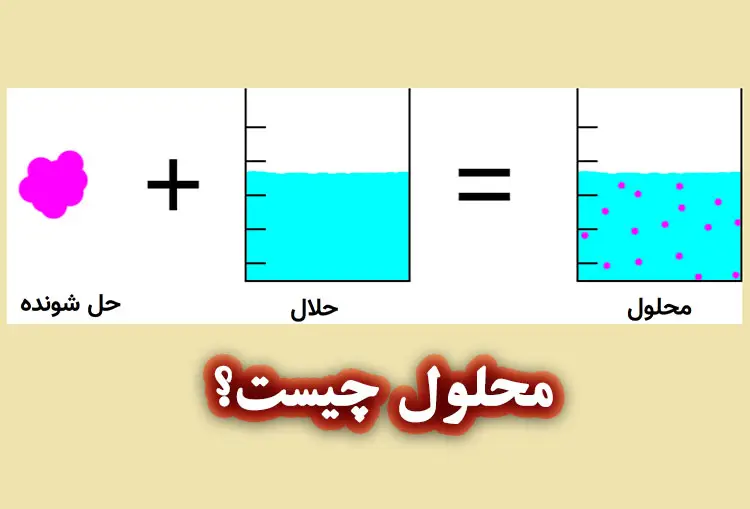
در بطن هر محصول مایع یا حتی جامد در صنعت شما، محلولها نهفتهاند. شناخت دقیق این مخلوطهای یکنواخت، اولین گام برای کنترل و بهینه سازی ویژگیهای محصولاتتان است.
تعریف پایه محلول
محلول به مخلوطی همگن از دو یا چند ماده گفته میشود که ذرات تشکیلدهندهی آن بهطور یکنواخت در یکدیگر پخش شدهاند و حالت فیزیکی و ترکیب شیمیایی محلول در سرتاسر آن یکسان و یکنواخت است. این تعریف به این معناست که برخلاف مخلوطهای ناهمگن، در محلول نمیتوان اجزا را با چشم غیر مسلح از یکدیگر تمایز داد.
ارکان اصلی هر محلول: حلال و حل شونده
هر محلول حداقل از دو جزء اصلی تشکیل شده است: حلال و حل شونده. تشخیص این دو جزء برای درک رفتار محلول ضروری است:
حلال: عامل اصلی انحلال
حلال مادهای است که جزء دیگر (حل شونده) را در خود حل میکند و معمولاً در محلول به نسبت بیشتری وجود دارد. بهطور کلی، حلالها عمدتاً مایع هستند، اما میتوانند جامد، گاز، یا حتی مادهای فوق بحرانی نیز باشند. به عنوان مثال، در محلول آبنمک، آب حلال است، یا در آلیاژ برنز که عمدتاً از مس تشکیل شده است، مس حلال محسوب میشود. در مواردی که حالت فیزیکی حلال و حل شونده یکسان است، جزء با تعداد مول یا کسر مولی بیشتر، حلال در نظر گرفته میشود.
حل شونده: مادهای که حل میشود
حل شونده به مادهای گفته میشود که در حلال، حل میشود و معمولاً در محلول به نسبت کمتری نسبت به حلال وجود دارد. حل شونده میتواند در اشکال مختلفی از جمله گاز، مایع یا جامد باشد. به عنوان مثال، در چای شیرین، آب حلال و شکر و عصاره چای حل شونده هستند. در محلول اسید سولفوریک ۱ مولار، اسید سولفوریک حل شونده است، در حالی که آب حلال است.
نحوه تشخیص حلال و حل شونده: اگر حالت فیزیکی حلال و حل شونده متفاوت باشد، جزء تعیینکنندهی فاز محلول، حلال است و در این موارد، معمولاً حل شونده تغییر فاز میدهد (مثال: نمک جامد در آب مایع، محلول مایع میشود، پس آب حلال است).
طبقهبندی محلولها: درک عمیقتر ترکیبات
محلولها را میتوان بر اساس معیارهای مختلفی طبقهبندی کرد که هر کدام به درک بهتر رفتار آنها در کاربردهای صنعتی کمک میکند.
دستهبندی بر اساس حالت فیزیکی اجزا
محلولها بر اساس حالت فیزیکی اجزای سازنده میتوانند انواع مختلفی داشته باشند:
- گاز در گاز: مانند هوا که مخلوطی از نیتروژن (حلال) و اکسیژن و سایر گازها (حل شونده) است.
- گاز در مایع: مانند آب گازدار که دی اکسید کربن در آب حل شده است.
- مایع در گاز: مانند هوای مرطوب که آب (مایع) در هوا (گاز) حل شده است.
- مایع در مایع: مانند سرکه که اسید استیک در آب حل شده است. اتانول و آب نیز به هر نسبتی در یکدیگر حل میشوند.
- جامد در مایع: مانند چای شیرین که شکر (جامد) در چای (مایع) حل شده است. این رایجترین نوع محلول در طبیعت است.
- جامد در جامد: مانند آلیاژها (مثل برنز که از مس و قلع تشکیل شده است).
محلولهای آبی و غیرآبی: انتخابی برای هر نیاز
محلولها در یک دستهبندی مهم دیگر به دو دستهی محلولهای آبی و غیرآبی تقسیم میشوند.
آب: حلال همهکاره با قطبیت خاص
محلول های آبی آنهایی هستند که حلال آنها آب است. آب بهعنوان فراوانترین و متداولترین حلال شناخته شده و به دلیل قطبیت بالا، قادر است طیف وسیعی از ترکیبات یونی و کووالانسی را در خود حل کند. مولکول آب دارای دو سر باردار مثبت (هیدروژن) و منفی (اکسیژن) است که این ویژگی باعث جذب ذرات حل شوندهی باردار و جداسازی آنها از یکدیگر میشود. بسیاری از فرآیندهای بیوشیمیایی حیاتی در بدن موجودات زنده، مانند هضم و جذب مواد غذایی، در محلولهای آبی انجام میشوند. در صنایع شیمیایی نیز، بخش عمدهای از واکنشها در محلولهای آبی صورت میگیرد.
حلالهای آلی: تنوع و کاربردها
محلول های غیرآبی (یا محلولهای آلی) آن هایی هستند که حلال آنها مادهای غیر از آب، معمولاً یک حلال آلی است. این حلالها بر اساس ساختار شیمیاییشان به دستههای مختلفی تقسیم میشوند.
انواع حلالهای آلی:
- حلالهای هیدروکربنی: بر اساس “اسکلت کربن” مولکولهایشان طبقهبندی می شوند، شامل آلیفاتیک (مانند هگزان و اوکتان)، آروماتیک (مانند بنزن و تولوئن) و پارافینی. هگزان ناقطبی است و در آب حل نمیشود.
- حلالهای اکسیژنه: از واکنشهای شیمیایی الفینها تولید میشوند و شامل الکلها (مانند اتانول و متانول), کتونها (مانند استون), استرها, اترها, گلیکول اترها و استرهای گلیکول اتر هستند. اتانول و استون، هر دو قطبی هستند و به هر نسبتی در آب حل میشوند و میتوانند پیوند هیدروژنی با آب تشکیل دهند.
- حلالهای هالوژنه: حاوی هالوژنهایی مانند کلر، برم یا ید هستند. پرکلرواتیلن که در خشکشویی استفاده میشود، نمونهای از این دسته است.
حلالها کاربرد های گستردهای در زندگی روزمره و صنایع دارند، از جمله در رنگها، پاک کننده ها، صنایع شیمیایی، نفت و گاز، و داروسازی.
انحلال پذیری: ظرفیت پنهان مواد
انحلال پذیری یک ویژگی حیاتی است که تعیین میکند چه مقدار از یک ماده در حلال مشخصی حل میشود. این مفهوم در کنترل غلظت و تولید محصولات با ویژگیهای مطلوب، از اهمیت بالایی برخوردار است.
تعریف دقیق انحلال پذیری
انحلال پذیری عبارت است از بیشترین مقدار یک ماده بر حسب گرم که در 100 گرم از یک حلال معین (معمولاً آب) در دمای مشخصی حل میشود. این مقدار برای هر ترکیب در دمای معین، یک عدد مشخص است. به عنوان مثال، در دمای ۷۰ درجه سلسیوس، ۵۰ گرم پتاسیم کرومات در ۱۰۰ گرم آب حل میشود تا محلول سیر شدهی آن حاصل گردد.
دستهبندی مواد بر اساس انحلال پذیری در آب
مواد بر اساس میزان انحلال پذیری آنها در آب (در دمای معین) به سه دسته تقسیم میشوند:
- مواد محلول: موادی که انحلال پذیری آنها بیشتر از ۱ گرم در ۱۰۰ گرم آب باشد. مانند شکر، سدیم نیترات و سدیم کلرید.
- مواد نامحلول: موادی که انحلال پذیری آن ها کمتر از ۰.۰۱ گرم در ۱۰۰ گرم آب باشد. مانند کلسیم فسفات، نقره کلرید و باریم سولفات.
- مواد کم محلول: موادی که انحلال پذیری آنها بین ۰.۰۱ تا ۱ گرم در ۱۰۰ گرم آب باشد. مانند کلسیم سولفات.
فرآیند انحلال از منظر ترمودینامیکی
پدیده انحلال برای خود به خودی بودن، نیاز به مساعد بودن حداقل یکی از دو عامل آنتالپی و آنتروپی دارد. وقتی چیزی حل میشود، انتقال گرما رخ میدهد و آنتروپی افزایش مییابد که باعث میشود محلول از نظر ترمودینامیکی پایدارتر از ماده حل شده و حلال باشد.
آنتالپی انحلال: گرمای پنهان در فرآیند
آنتالپی انحلال (یا گرمای انحلال) به تغییر آنتالپی مربوط به حل شدن یک مول مادهی حل شونده در مقدار زیادی حلال اطلاق میشود (نماد: ΔH انحلال). برای فرآیند انحلال، این مقدار میتواند گرماده (ΔH منفی) یا گرماگیر (ΔH مثبت) باشد. به عنوان مثال، انحلال ترکیب یونی کلسیم کلرید در آب گرماده است، به این معنی که دمای محلول افزایش مییابد. در مقابل، انحلال گرماگیر با کاهش دمای محلول همراه است. انحلال اتانول در آب، برخلاف شکر، گرماده است.
آنتروپی: نیروی محرکه بینظمی
آنتروپی (بینظمی) نیز نقش مهمی در انحلال دارد. بهطور کلی:
- حل شدن جامد در مایع: آرايش منظم ذرات جامد از بین رفته و تحرک و آزادی عمل ذرات بیشتر میشود، بنابراین آنتروپی افزایش مییابد.
- حل شدن مایع در مایع: حجم محلول در مقایسه با دو مایع جدا از هم بیشتر میشود و تحرک ذرات دو مایع در حالت محلول نسبت به قبل افزایش مییابد، بنابراین آنتروپی افزایش مییابد.
- حل شدن گاز در مایع: نیروی جاذبهی بین مولکولهای گاز افزایش یافته و آزادی عمل مولکولها کمتر میشود، در نتیجه آنتروپی کاهش مییابد.
توجه: هر انحلالی برای خودبهخودی بودن، نیاز به سطح انرژی پایینتر و آنتروپی بیشتر دارد. اما اگر انحلال با کاهش بینظمی (آنتروپی) همراه باشد، مانند انحلال گازها در مایعات، این پدیده نباید به هر مقداری انجام شود و باید تعادلی باشد.
عوامل کلیدی مؤثر بر انحلال پذیری
میزان انحلال پذیری مواد به عوامل متعددی بستگی دارد که شناخت آنها برای فرمولاسیون محصولات شما ضروری است.
قاعدهی طلایی “شبیه، شبیه را حل میکند”
یکی از اساسیترین اصول در شیمی انحلال این است که مواد قطبی در حلالهای قطبی و مواد غیرقطبی در حلالهای غیرقطبی بهتر حل میشوند. به عبارت دیگر، هر مادهای در حلالی بهتر حل میشود که از نظر نیروهای جاذبهی بین ذرات تشکیلدهندهشان شبیه به یکدیگر باشند.
- مثال: نمک (یونی و قطبی) و شکر (مولکولی و قطبی) در آب (قطبی) حل میشوند. روغنها (ناقطبی) در آب (قطبی) حل نمیشوند، اما در حلالهای ناقطبی مانند هگزان حل میشوند. ید (ناقطبی) در هگزان (ناقطبی) حل میشود.
تأثیر دما: معادلهای پویا در انحلال
تأثیر دما بر انحلال پذیری مواد متغیر است و به ماهیت فرآیند انحلال (گرماده یا گرماگیر) بستگی دارد.
- انحلال گرماگیر: اگر انحلال گرماگیر باشد، با افزایش دما، انحلال پذیری ماده حل شونده بیشتر میشود. این پدیده طبق اصل لوشاتلیه قابل توجیه است، زیرا افزایش دما، تعادل را به سمت واکنشدهنده (که گرما در آن سمت است) پیش میبرد و انحلال پذیری را افزایش میدهد.
- انحلال گرماده: اگر انحلال گرماده باشد، با افزایش دما، انحلال پذیری ماده حل شونده کمتر میشود. در این حالت، افزایش دما تعادل را به سمت چپ پیش میبرد و انحلال پذیری کاهش مییابد.
نکته: تأثیر افزایش یا کاهش دما بر انحلال پذیری مایعات در مایعات (مخلوطهای قابل امتزاج) معمولاً بیتأثیر است. اما انحلال پذیری گازها با افزایش دما کاهش مییابد و با کاهش دما افزایش پیدا میکند.
ابعاد ذرات حل شونده و هم زدن: سرعت یا ظرفیت؟
اندازهی مولکول حل شونده معمولاً با انحلال پذیری رابطه معکوس دارد، یعنی هر چه اندازه مولکول کوچکتر باشد، انحلال پذیری بیشتر است. همچنین، سطح در معرض حل شونده نیز عامل مهمی در سرعت حل شدن است. به عنوان مثال، نمک ریزتر به دلیل سطح تماس بیشتر با آب، سریعتر حل میشود تا نمک درشت.
هم زدن تنها سرعت حل شدن را افزایش میدهد، نه خود انحلال پذیری را. هم زدن باعث حرکت حلال شده و مادهی حل شونده را در قسمتهای تازهی حلال قرار میدهد.
فشار: عاملی مهم برای گازها
فشار بر انحلال پذیری مواد جامد و مایع در مایعات تأثیر کمی دارد، اما برای گازها عامل بسیار مهمی است. طبق قانون هنری، انحلال پذیری گازها در حلال مایع با فشار گاز رابطهی مستقیم دارد، یعنی با افزایش فشار، انحلال پذیری گاز در آب بیشتر میشود (در دمای ثابت). به عنوان مثال، نوشابههای گازدار با این اصل تولید میشوند.
اثر یون مشترک: پدیدهای که حلالیت را کاهش میدهد
اثر یون مشترک پدیدهای است که در آن، اگر به محلولی که در حال تعادل شیمیایی است، نمکی اضافه شود که یون آن از قبل در محلول وجود دارد، حلالیت آن نمک کاهش مییابد. این اصل در جداسازی و خالصسازی مواد در صنعت کاربرد دارد.
وضعیتهای مختلف محلول: از سیر نشده تا فراسیر شده
شناخت وضعیت اشباع یک محلول، برای کنترل دقیق فرآیندهای کریستالیزاسیون و جلوگیری از رسوبگذاری ناخواسته در محصولات شما حیاتی است.
محلول سیر نشده: ظرفیت پذیرش بیشتر
محلول سیر نشده محلولی است که در یک دمای معین، میتواند مقدار بیشتری از مادهی حل شونده را در خود حل کند. در این محلول، مقدار مادهی حل شونده کمتر از مقدار انحلال پذیری آن ماده در همان دما است. بیشتر محلولهایی که در طبیعت وجود دارند، محلولهای سیر نشده هستند.
محلول سیر شده: نقطه تعادل
محلول سیر شده (یا اشباع) محلولی است که در دمای معین، دیگر نمیتواند مقدار بیشتری از مادهی حل شونده را در خود حل کند. در این محلول، بین مادهی حل شونده و حلال، تعادل دینامیکی برقرار میشود، به این معنی که سرعت حل شدن ماده با سرعت خارج شدن آن از محلول (رسوب یا خروج گاز) برابر است و غلظت مادهی حل شونده ثابت میماند.
محلول فراسیر شده: وضعیتی ناپایدار
محلول فراسیر شده (یا فوق اشباع) محلولی است که در دمای معین، مقدار حل شوندهی موجود در آن بیشتر از مقدار انحلال پذیری آن ماده در همان دما باشد. این محلولها ناپایدار هستند و با کوچکترین تحریک (مانند ضربه، تغییر ناگهانی دما، افزودن یک بلور کوچک از همان ماده) مقدار اضافی حل شونده به سرعت رسوب میکند. تهیهی محلول فراسیر شده اغلب با سرد کردن آرام یک محلول سیر شده در دمای بالا انجام میشود.
برهمکنشهای مولکولی در انحلال: عمق شیمی محلول
درک چگونگی برهمکنش مولکولهای حلال و حل شونده در سطح اتمی و مولکولی، به شما امکان میدهد تا پایداری، عملکرد و رسانایی محصولات خود را پیشبینی و کنترل کنید.
انحلال ترکیبات یونی در آب: پدیدهی آبپوشی
هنگامی که یک ترکیب یونی (مانند نمک طعام یا سدیم کلرید) به آب اضافه میشود، یونهای مثبت و منفی در ترکیب یونی از هم باز میشوند (فروپاشی شبکه). مولکولهای قطبی آب، این یونها را احاطه میکنند؛ یونهای منفی توسط سر مثبت مولکول آب (اتمهای هیدروژن) و یونهای مثبت توسط سر منفی مولکول آب (اتمهای اکسیژن) محاصره میشوند. به این فرآیند آبپوشی (Hydration) گفته میشود. برقراری جاذبه بین یونها و مولکولهای آب، یک فرآیند گرماده است.
انحلال ترکیبات کووالانسی: نقش پیوندهای هیدروژنی
حل شوندههای کووالانسی، هنگام حل شدن در آب، به مولکولهای مجزا تفکیک میشوند. اگر این ترکیبات قطبی باشند، میتوانند با مولکولهای آب پیوندهای هیدروژنی تشکیل دهند. به عنوان مثال، شکر یک ترکیب کووالانسی قطبی است که مولکولهای گلوکزش هنگام حل شدن در آب توسط مولکولهای آب احاطه میشوند و پیوندهای هیدروژنی آب-شکر جایگزین پیوندهای هیدروژنی شکر-شکر و آب-آب میشوند.
الکترولیتها و غیرالکترولیتها: رسانایی و تفکیک یونی
مواد بر اساس توانایی آنها در تولید یون و رسانایی جریان برق در محلول، طبقهبندی میشوند:
- الکترولیتهای قوی: شامل اسیدهای قوی، بازهای قوی و ترکیبات یونی هستند که انحلال آنها در آب کاملاً به صورت یونی انجام میشود. این مواد به خوبی به یونهای سازندهی خود تفکیک میشوند و رسانای خوب جریان برق هستند. بسیاری از نمکها مانند سدیم کلرید (NaCl)، پتاسیم نیترات (KNO3)، و اسیدهای قوی مانند هیدروکلریک اسید (HCl) در این دسته قرار میگیرند.
- الکترولیتهای ضعیف: شامل اسیدهای ضعیف و بازهای ضعیف هستند که انحلال آنها در آب عمدتاً به صورت مولکولی و اندکی هم به صورت یونی انجام میشود. این مواد رسانای ضعیف جریان برق هستند.
- غیرالکترولیتها: شامل برخی مواد مولکولی مانند اتانول، استون و ساکاروز (شکر) هستند که انحلال آنها در آب کاملاً به صورت مولکولی انجام میشود. این مواد در محلول به یون تفکیک نمیشوند و به همین جهت محلول آنها رسانای جریان برق نیست.
درصد تفکیک یونی نمایانگر نسبت درصدی تفکیک یونی مولکولهای یک ماده به هنگام حل شدن در آب است.
راهکارهای عملی در صنایع صابونسازی و آرایشی-بهداشتی
دانش مربوط به محلولها مستقیماً در قلب عملیات تولید شما قرار میگیرد و نقش بسزایی در فرمولاسیون، کیفیت و کارایی محصولاتتان دارد.
کاربرد محلولها در فرمولاسیون و تولید
در فرمولاسیون صابون ها، شوینده ها و محصولات آرایشی-بهداشتی، اغلب با نیاز به حل کردن مواد مختلف (مانند سورفکتانت ها، عطرها، رنگها، نگهدارنده ها و مواد فعال) در حلالهای آبی یا آلی مواجه هستید. انتخاب حلال مناسب بر اساس اصل “شبیه، شبیه را حل میکند”، برای اطمینان از انحلال کامل و یکنواخت اجزا، بسیار حیاتی است. به عنوان مثال، برای حل کردن چربیها و روغن های ناقطبی، نیاز به حلالهای ناقطبی دارید. اتانول به عنوان یک حلال صنعتی مهم پس از آب، در تهیهی مواد آرایشی و بهداشتی کاربرد فراوان دارد. استون نیز حلالی برای چربیها، رنگها و انواع لاک است.
جداسازی و خالصسازی: ارتقاء کیفیت محصول
روشهای جداسازی مواد بر اساس حلالیت، از بهترین راهکارها در صنعت برای خالصسازی محصولات و جداسازی ناخالصیها هستند.
روشهای جداسازی بر اساس حلالیت:
- جداسازی به روش انحلال: در این روش، یک ماده در یک حلال خاص حل میشود، در حالی که مادهی دیگر حلالیت جزئی دارد یا اصلاً حل نمیشود. سپس جزء محلول از جزء نامحلول با صاف کردن جدا میشود.
- جداسازی به روش کریستالیزاسیون: از تفاوت در انحلال پذیری مواد در دماهای مختلف استفاده میکند. با تغییر دما (معمولاً سرد کردن)، مادهای با انحلال پذیری کمتر یا شیب انحلال پذیری بیشتر نسبت به دما، به صورت کریستال از محلول جدا میشود. این روش در مورد ترکیبات مختلف پتاسیم (مانند KCl و KNO3) قابل انجام است.
- جداسازی به روش اشباع یون: با افزایش غلظت یک یون مشترک در محلول، نمک حاوی آن یون به نقطه اشباع میرسد و به صورت کریستالی رسوب میکند.
- جداسازی به روش دو حلالی: زمانی استفاده میشود که دو ماده هر کدام در یک حلال خاص بیشتر حل میشوند. با افزودن حلال دوم، میتوان مواد را بر اساس حلالیت انتخابیشان جداسازی کرد. به عنوان مثال، اگر اتر در اتانول حل شده باشد، با افزودن هگزان نرمال (حلال آلی)، اتر از اتانول جدا میشود.
کنترل کیفیت و پایداری محصول
غلظت یک محلول برابر با مقدار حل شونده در مقدار معینی از حلال یا محلول تعریف میشود. با افزودن حل شونده در حجم ثابت، غلظت افزایش و با افزودن حلال، غلظت کاهش مییابد. درک دقیق غلظتها، اطمینان از کارایی محصول و پایداری آن در طول زمان را تضمین میکند. استفاده از محلولهای سیر شده یا فراسیر شده در محصولات نهایی میتواند منجر به رسوبگذاری یا تغییرات ناخواسته در بافت و ظاهر محصول شود.
تفاوتهای اساسی: محلول، کلوئید و سوسپانسیون
برای تولید محصولات پایدار و با ظاهر مطلوب، درک تمایز میان محلولها، کلوئید ها و سوسپانسیون ها ضروری است. این سه نوع مخلوط، بر اساس اندازهی ذرات حل شده و ویژگیهای ظاهری و رفتاری خود، از یکدیگر متمایز میشوند.
تعاریف و ویژگیهای متمایز کننده
محلول
محلول ها مخلوط های همگن هستند که از ذرات بسیار ریز (مولکول یا یون) تشکیل شدهاند. اندازه ذرات در محلولها بین ۰.۰۱ تا ۱ نانومتر است که کوچکترین ذرات را در بین انواع مخلوطها دارند. محلولها شفاف و پایدارند و ذرات حل شونده حتی با گذشت زمان هم تهنشین نمیشوند. همچنین، در محلولها، مسیر انتشار نور (اثر تیندال) مشخص نیست زیرا ذرات ریز نور را پراکنده نمیکنند.
کلوئید
کلوئیدها (یا چسبسانها) مخلوطهای ناهمگن هستند که ذرات حل شوندهی آنها بزرگتر از محلولها و کوچکتر از سوسپانسیونها هستند. اندازه ذرات کلوئیدها بین ۱ تا ۱۰۰۰ نانومتر است. کلوئیدها کدر به نظر میرسند. ذرات کلوئیدی قادر به عبور از کاغذ صافی هستند، اما با اولترافیلترها حفظ میشوند. کلوئیدها پایدار هستند و به مرور زمان تهنشین نمیشوند. یکی از ویژگیهای بارز کلوئیدها، اثر تیندال است؛ یعنی ذرات آنها میتوانند نور را پراکنده کنند و مسیر انتشار نور در آنها قابل تشخیص است. حرکت براونی (حرکات نامنظم دائمی ذرات) و بار الکتریکی ذرات کلوئیدی نیز از دیگر خواص آنهاست. کلوئیدها کاربردهای زیادی در صنایع غذایی، دارویی، تصفیه فاضلاب و هوا، صنایع رنگ و پلاستیک، مواد روانکننده، چسبها و شویندهها دارند.
سوسپانسیون
سوسپانسیون ها مخلوطهای ناهمگنی هستند که ذرات جامد در مایع به صورت معلق وجود دارند. این ذرات به نسبت بزرگ هستند و میتوان آنها را با چشم دید، معمولاً قطر آنها حتی از ۱۰۰۰ نانومتر (یا ۱ میکرومتر) بزرگتر است. سوسپانسیونها ناپایدارند و ذرات سازندهی آنها پس از گذشت زمان تهنشین میشوند. سوسپانسیونها نیز مانند کلوئیدها کدر هستند و توانایی عبور از صافی را ندارند. مسیر انتشار نور در سوسپانسیونها نیز مشخص است. آب گلآلود و آبلیمو با تفاله مثالهایی از سوسپانسیون هستند.
مقایسهی جامع
جدول زیر تفاوتهای کلیدی بین محلول، کلوئید و سوسپانسیون را خلاصه میکند:
| ویژگی | محلول | کلوئید | سوسپانسیون |
|---|---|---|---|
| اندازه ذرات | ۰.۰۱ تا ۱ نانومتر (کوچکترین) | ۱ تا ۱۰۰۰ نانومتر | > ۱۰۰۰ نانومتر (بزرگترین) |
| همگن/ناهمگن | همگن | ناهمگن | ناهمگن |
| تهنشینی ذرات | تهنشین نمیشوند (پایدار) | تهنشین نمیشوند (پایدار) | تهنشین میشوند (ناپایدار) |
| عبور از صافی | عبور میکنند | عبور میکنند (به جز اولترافیلتر) | عبور نمیکنند |
| پراکندگی نور | نور را پراکنده نمیکنند (شفاف) | نور را پراکنده میکنند (اثر تیندال) | نور را پراکنده میکنند |
| ظاهر | شفاف | کدر/مات | کدر/مات |
| مشاهده ذرات | با چشم غیر مسلح غیرقابل مشاهده | با میکروسکوپ قابل مشاهده | با چشم غیر مسلح قابل مشاهده |
نتیجهگیری
محلولها در قلب صابون سازی، آرایشی و بهداشتی قرار دارند و درک عمیق آنها از جنبههای مختلف، نه تنها برای تولید محصولات استاندارد و با کیفیت بالا ضروری است، بلکه مسیر را برای نوآوری و توسعهی محصولات جدید هموار میکند. از شناخت طبیعت قطبی و ناقطبی حلالها و حل شوندهها گرفته تا کنترل دقیق انحلال پذیری تحت تأثیر دما و فشار، و همچنین تمایز دقیق میان محلولها، کلوئیدها و سوسپانسیونها، هر یک از این مفاهیم ابزاری قدرتمند در دستان شما بهعنوان نخبگان این صنعت است. با بهکارگیری این دانش، میتوانید فرمولاسیونهای پایدارتر، کارآمدتر و جذابتری را خلق کنید و جایگاه خود را در بازار رقابتی امروز تقویت نمایید. تسلط بر علم محلولها، سرمایهگذاری بر آیندهی روشن کسبوکار شماست.
سوالات متداول (FAQ)
چرا آب به عنوان یک حلال همهکاره شناخته میشود؟
آب به دلیل ساختار مولکولی قطبی خود، دارای دو سر با بار جزئی مثبت و منفی است. این قطبیت بالا به مولکولهای آب اجازه میدهد تا با گشتاور دو قطبی و توانایی تشکیل پیوندهای هیدروژنی، با یونها و مولکولهای قطبی دیگر (مانند نمکها و قندها) برهمکنش قوی برقرار کرده و آنها را در خود حل کند.
هم زدن چه تاثیری بر انحلال پذیری دارد؟
هم زدن (Stirring) تنها سرعت حل شدن یک ماده را افزایش میدهد و تأثیری بر میزان انحلال پذیری آن ماده در حلال ندارد. با هم زدن، مولکولهای حلال تازهتر به سطح مادهی حل شونده رسیده و فرآیند انحلال سریعتر پیش میرود.
تفاوت الکترولیت و غیرالکترولیت چیست؟
الکترولیتها موادی هستند که هنگام حل شدن در آب، بهطور کامل یا جزئی تفکیک شده و یون ایجاد میکنند، در نتیجه محلول آنها قادر به رسانایی جریان برق است. مثالها شامل نمکها، اسیدهای قوی و بازهای قوی هستند. در مقابل، غیرالکترولیتها موادی مولکولی هستند که هنگام انحلال در آب، یون تولید نمیکنند و محلول آنها رسانای جریان برق نیست. مثالها شامل شکر، اتانول و استون هستند.
چگونه میتوان یک محلول فراسیر شده تهیه کرد؟
برای تهیهی یک محلول فراسیر شده، معمولاً یک محلول سیر شده از مادهای که انحلال پذیری آن با افزایش دما زیاد میشود، در دمای بالا تهیه میشود. سپس این محلول به آرامی و بدون هیچگونه تحریکی سرد میشود. در این حالت، مقدار حل شوندهی موجود در محلول، بیشتر از مقدار انحلال پذیری آن در دمای پایینتر خواهد بود و محلول در وضعیت ناپایدار قرار میگیرد.
آیا همهی مواد محلول در آب، رسانای جریان برق هستند؟
خیر، همهی مواد محلول در آب رسانای جریان برق نیستند. فقط الکترولیت ها که هنگام انحلال در آب به یون تفکیک میشوند، محلولی رسانا تولید میکنند. غیرالکترولیت ها (مانند شکر و اتانول) که بهطور مولکولی در آب حل میشوند و یون تولید نمیکنند، محلولهایی نارسانا تشکیل میدهند.
رفع مسئولیت پزشکی
توجه: مطالب این وبسایت جنبه اطلاعرسانی داشته و جایگزین معاینه و تشخیص پزشک نیست. هرگز بدون مشورت با متخصص، دارو مصرف نکنید یا درمان خود را تغییر ندهید.


نظرات (0)
هنوز نظری ثبت نشده است. اولین نفر باشید!
ثبت نظر جدید