💎 فهرست مطالب
📌 خلاصه مقاله
⏱️ زمان مطالعه: 1 دقیقه
این مقاله به بررسی جامع مواد الکترولیت و غیر الکترولیت میپردازد و تفاوت آنها را در تولید یون و هدایت الکتریکی در محلولهای آبی تشریح میکند. مواد الکترولیت که به دو دسته قوی و ضعیف تقسیم میشوند، نقش حیاتی در فرایندهای صنعتی مانند صابونسازی، تولید باتری و تصفیه آب ایفا میکنند، در حالی که غیر الکترولیتها یون تولید نمیکنند. همچنین، روشهای کلیدی اندازهگیری غلظت محلولها مانند ppm و درصد جرمی نیز توضیح داده شده است که برای درک بهتر ترکیبات شیمیایی ضروری است.
- مواد الکترولیت در محلولهای آبی یونیزه شده و جریان الکتریکی را هدایت میکنند، در حالی که غیر الکترولیتها به صورت مولکولی حل شده و یون تولید نمیکنند.
- الکترولیتها بر اساس میزان یونیزاسیون به دو دسته قوی (یونیزاسیون کامل) و ضعیف (یونیزاسیون ناقص) تقسیم میشوند که هر کدام شامل اسیدها، بازها و نمکهای خاصی هستند.
- شناخت و استفاده صحیح از الکترولیتها در صنایع مختلف از جمله صابونسازی برای تنظیم pH، افزایش قوام و استحکام محصول نهایی بسیار حیاتی است.
- غیر الکترولیتها اغلب شامل ترکیبهای آلی (بهجز اسیدها و بازهای آلی) مانند متانول، شکر و گلیسرین هستند که در محلولهای آبی یون تولید نمیکنند.
- روشهای مختلفی برای اندازهگیری غلظت محلولها مانند قسمت در میلیون (ppm) و درصد جرمی (%w/w) وجود دارد که برای درک مقدار ماده حلشونده در محلول ضروری است.
در شیمی، ترکیبها را از نظر رفتار در محلولها به دو دستهی الکترولیت و غیر الکترولیت تقسیم میکنند. این تقسیمبندی نقش اساسی در درک خواص رسانایی الکتریکی، واکنشپذیری و کاربردهای صنعتی مانند صابون سازی دارد. در این مقاله، انواع مواد الکترولیت و غیر الکترولیت، ویژگیها، نمونهها، کاربردها و نیز روشهای اندازهگیری غلظت محلولها بررسی شده است. این دانش برای شیمیدانان، تولیدکنندگان و علاقهمندان به محصولات دستساز، بهویژه در زمینه صابونسازی بسیار حیاتی است.
مواد غیر الکترولیت
موادی هستند که به صورت کاملا مولکولی حل شده و بر اثر انحلال، یون تولید نمیکنند. به محلول این مواد محلول غیر الکترولیت میگویند.
- اغلب ترکیبهای آلی (البته بهجز اسید ها و بازهای آلی) مانند متانول، اتانول، استون، شکر (یا همان ساکاروز) و گلیسرین غیر الکترولیت هستند. محلول ترکیبهای ناقطبی مانند I2 وBr2 در حلالهای ناقطبی مانند هگزان و نفت نیز محلول غیر الکترولیت به شمار میروند.
مواد الکترولیت
الکترولیت (Electrolyte)، ترکیبی است که در محلول آبی (aqueous solution) یونیزه میشود. یون مثبت (کاتیون) از یون منفی (آنیون) جدا میشود. از آنجایی که یونها حامل بار هستند، محلولهای الکترولیت جریان الکتریکی را هدایت میکنند. اگر یونیزاسیون (ionization) کامل باشد، الکترولیتها قوی و اگر ناقص باشد، ضعیف در نظر گرفته میشوند.
در ساخت صابون، الکترولیتها نقش مهمی ایفا میکنند. آنها میتوانند به تنظیم pH محلول کمک کنند و در تثبیت و قوام ساختار صابون نقش داشته باشند. به عنوان مثال، نمکهای معمولی مانند سدیم کلرید (NaCl) به عنوان الکترولیتهای قوی در فرآیند صابون سازی مورد استفاده قرار میگیرند تا سختی و استحکام صابون را افزایش دهند.
شناخت صحیح و استفاده مناسب از الکترولیتها میتواند به بهبود کیفیت نهایی صابونهای دست ساز شما کمک کند. پس همواره به ترکیبات و نقش آنها در فرآیند تولید توجه کنید تا محصولاتی با کیفیت و کارایی بالا تولید کنید.
الکترولیت های قوی
به الکترولیتهایی گفته میشود که به هنگام انحلال در آب به طور کامل یا به طور عمده یونیده میشوند. اسیدهای قوی (HCl -HBr – HI- H2SO4 – HNO3 – HClO4) بازهای قوی (هیدروکسید فلزات قلیایی و قلیایی خاکی البته از Ca به پایین) و اغلب نمکها (مانند MgCl2 و …) الکترولیت قوی هستند.
الکترولیت های ضعیف
به الکترولیتهایی گفته میشود که به هنگام انحلال در آب بیشتر به شکل مولکولی حل شده و تعداد کمی از مولکولهای آنها یونیده میشود. اسیدهای ضعیف مانندHF و استیک اسید (CH3COOH) و بازهای ضعیف مانند آمونیاک (NH3) و آمینها جزو الکترولیتهای ضعیف هستند.
غلظت
شیمیدانها غلظت یک محلول را برابر مقدار حل شونده در مقدار معینی از حلال و یا محلول تعریف میکنند. غلظت محلولها را به روشهای گوناگون بیان میکنند که مهمترین آنها عبارتند از:
- قسمت در میلیون (ppm)
- درصد جرمی (%w/w)
- غلظت مولی یا مولار (M)
قسمت در میلیون (ppm)
غلظت ppm نشان میدهد که در یک میلیون گرم ازمحلول، چند گرم حل شونده وجود دارد.
با استفاده از رابطهی زیر میتوان غلظت ppm را به دست آورد. دراین رابطه، یکای جرم درصورت و مخرج کسر یکسان میباشد.

برای محاسبهی ppm از رابطهی زیر نیز میتوان استفاده کرد:
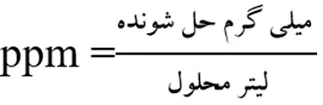
درصدجرمی (%w/w)
به مقدار گرم مادهی حلشونده در 100 گرم از یک محلول، درصد جرمی مادهی حل شونده در این محلول میگویند.
با استفاده از رابطهی زیر میتوان درصد جرمی را به دست آورد. دراین رابطه، یکای جرم درصورت و مخرج کسر یکسان میباشد.

نقش الکترولیتها در فرایندهای صنعتی و آزمایشگاهی
الکترولیتها تنها محدود به کاربرد در صابون سازی نیستند؛ بلکه در بسیاری از فرایندهای صنعتی مانند الکترولیز، تولید باتریها، تصفیه آب، پزشکی (الکترولیتهای سرم) و حتی در تنظیم تعادل یونی بدن در علم تغذیه نقش دارند.
در آزمایشگاهها، انتخاب الکترولیت مناسب میتواند بر سرعت و نوع واکنش شیمیایی تأثیر بگذارد. به عنوان مثال، حضور یک الکترولیت قوی در واکنشهای تجزیه الکتریکی، باعث افزایش کارایی میشود.
نتیجهگیری
درک تفاوت بین مواد الکترولیت و غیر الکترولیت برای شیمیدانان و تولیدکنندگان محصولات شیمیایی، خصوصاً در حوزههایی مانند صابونسازی، حیاتی است. شناخت قدرت یونیزاسیون یک ترکیب، ما را در پیشبینی رفتار آن در محلول کمک میکند. همچنین آشنایی با روشهای اندازهگیری غلظت مانند ppm و درصد جرمی به درک بهتر از مقدار ماده حلشونده در محلول منجر میشود. در نهایت، استفاده هوشمندانه از این اطلاعات میتواند به افزایش کیفیت، ایمنی و کارایی محصولات نهایی منجر شود.
سوالات متداول (FAQ)
تفاوت الکترولیت و غیر الکترولیت چیست؟
الکترولیتها در محلول آبی یون تولید کرده و جریان الکتریسیته را هدایت میکنند، در حالی که غیر الکترولیتها یون تولید نمیکنند و رسانای برق نیستند.
آیا همه نمکها الکترولیت قوی هستند؟
خیر، بیشتر نمکها الکترولیت قویاند، اما برخی مانند نمکهای آلی ممکن است یونیزاسیون جزئی داشته باشند و به عنوان الکترولیت ضعیف در نظر گرفته شوند.
چرا شناخت الکترولیتها در صابونسازی اهمیت دارد؟
الکترولیتها به تنظیم pH، کنترل قوام و افزایش استحکام صابون کمک میکنند. استفاده صحیح از آنها باعث بهبود کیفیت صابون دستساز میشود.
ppm و درصد جرمی چه تفاوتی دارند؟
ppm مقدار ماده حلشونده در یک میلیون قسمت محلول را نشان میدهد، در حالی که درصد جرمی میزان ماده حلشونده در 100 گرم محلول را بیان میکند.
آیا الکلها الکترولیت هستند؟
الکلهایی مانند اتانول و متانول معمولاً غیر الکترولیت هستند، چون در آب حل میشوند اما یون تولید نمیکنند.
رفع مسئولیت پزشکی
توجه: مطالب این وبسایت جنبه اطلاعرسانی داشته و جایگزین معاینه و تشخیص پزشک نیست. هرگز بدون مشورت با متخصص، دارو مصرف نکنید یا درمان خود را تغییر ندهید.


نظرات (0)
هنوز نظری ثبت نشده است. اولین نفر باشید!
ثبت نظر جدید