💎 فهرست مطالب
این مقاله با هدف آشنایی با مفاهیم پایهای و علمی اسید و باز تهیه شده است. در این متن، ویژگیهای عمومی، تعاریف علمی، مقایسه اسید و باز، نحوه یونش، قدرت اسیدی و بازی، مفهوم pH و واکنش خنثیسازی به زبان ساده و علمی بررسی شده است. این اطلاعات نه تنها برای دانشآموزان مفید است بلکه پایهای ضروری برای درک شیمی کاربردی در صنایع، آزمایشگاهها و فرایندهای زیست محیطی محسوب میشود.
خواص عمومی اسید ها:
- موادی ترش مزه هستند و در فرمول خود معمولا یک یا چند اتم H دارند.
- در دمای محیط pH کمتر از 7 دارند و کاغذ تورنسل را قرمز میکنند.
- با برخی از فلزات مانند آهن، روی و … ترکیب شده و گاز هیدروژن آزاد میکنند (خاصیت خورندگی).
- با بازها (و برخی از اکسیدهای فلزی) واکنش داده و نمک تولید میکنند.
- معمولا پس از انحلال درآب یونش مییابند و محلول حاصل، رسانای یونی میشود.
خواص عمومی بازها :
- بازها مزهی گس و تلخ دارند و در فرمول خود معمولا یک یا چند OH- (هیدروکسید) دارند.
- هنگام تماس با پوست دست و یا بدن حالتی مانند صابون دارند ( لزج هستند).
- در دمای محیط pH بیشتر از 7 دارند و کاغذ تورنسل را آبی رنگ میکنند.
- با اسیدها (و برخی از اکسیدهای نافلزی) واکنش داده و نمک تولید میکنند.
- معمولا پس از انحلال در آب یونش مییابند و محلول حاصل، رسانای یونی میشود.
تعریف اسید و باز – تعریف آرنیوس:

اسید آرنیوس مادهای است که در آب حل میشود و میزان یون H+ (aq) را افزایش میدهد و باز آرنیوس مادهای است که ضمن حل شدن در آب میزان یونOH-(aq) را افزایش میدهد.
- اکسیدهای فلزات در آب اغلب خاصیت بازی ( قلیایی) دارند (تولید هیدروکسید فلز میکنند).
- اکسیدهای نافلزات در آب، اغلب خاصیت اسیدی دارند.
- یونH+ به علت کوچکی و داشتن چگالی بار زیاد، در آب به صورت آب پوشیده درآمده و به صورت H3O+ وجود دارد.
اسیدهای قوی و ضعیف:
اسیدها براساس میزان یونش در آب به دو دسته قوی و ضعیف دستهبندی میشوند. اسیدهای قوی در آب تقریبا به طور کامل یونش مییابند اما اسیدهای ضعیف به طورجزئی یونیده میشود.
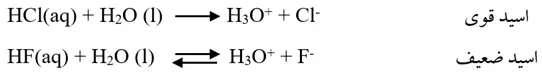
اغلب اکسیدهای نافلزی با آب واکنش داده و+ H تولید میکنند.
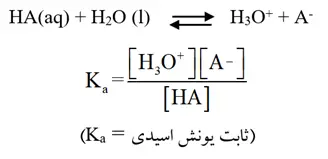
- قدرت اسید، به میزان انحلال آن در آب بستگی ندارد بلکه به درجه یونش (Α) یا درصد یونش (Α%) آن وابسته است.
- انحلال اسیدهای ضعیف در آب به صورت تعادلی است به همین دلیل میتوان برای آن رابطه ثابت تعادل نوشت (انحلال اسیدهای قوی در آب کامل و یک طرفه است).
- هرچه Ka اسیدی بزرگتر باشد، آن اسید قویتر است.
- اسیدهای قوی متداول عبارتند از:HCl ، HBr ، HI ، HClO4 ، HNO3 ، H2SO4
بازهای قوی و ضعیف:
بازها براساس میزان یونش در آب به دو دسته قوی و ضعیف دستهبندی میشوند. بازهای قوی در آب تقریبا به طور کامل یونش مییابند. اما بازهای ضعیف به طورجزئی یونیده میشوند.
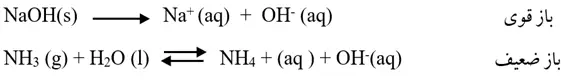
آمونیاک به دلیل تشکیل پیوند هیدروژنی به طور عمده به صورت مولکولی در آب حل میشود و میتوان برای آن فرمولNH4OH(aq) را در نظر گرفت. بنابراین معادله انحلال آمونیاک در آب را به صورت زیر هم میتوان نشان داد.
![]()
همانطور که قبلا اشاره شد، اکسیدهای فلزی (گروه اول و دوم) در آب یون OH- تولید میکنند.
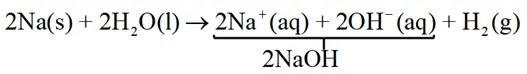
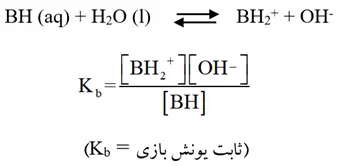
- قدرت باز، به میزان انحلال آن در آب بستگی ندارد بلکه به درجه یونش (Α) یا درصد یونش (Α%) آن وابسته است.
- انحلال بازهای ضعیف (مانند آمونیاک و آمینها) در آب به صورت تعادلی است به همین دلیل میتوان برای آن رابطه ثابت تعادل نوشت:
- هرچهKb بازی بزرگتر باشد، آن باز قویتر است.
- انحلال بازهای قوی در آب کامل و یک طرفه است.
- هیدروکسیدهای گروه اول و هیدروکسیدهای گروه دوم (بهجزBe(OH)2 و Mg(OH)2) بازهای قوی به شمار میروند.
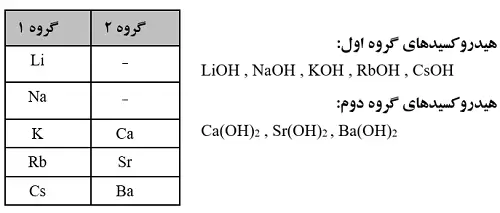
تفاوت خاصیت اسیدی و قدرت اسیدی:
خاصیت اسیدی تابع غلظت اسید مورد نظر است. بدین ترتیب که هرچه غلظت اسید بیشتر باشد، غلظت H3O+ بیشتر و در نتیجه خاصیت اسیدی بیشتر است .
قدرت اسیدی، تابع غلظت اسید نیست و فقط از روی ثابت یونش اسید (Ka) تعیین میشود. هرچه Ka برای یک اسید بیشتر باشد، قدرت آن بیشتر است.
مقیاس pH:
پی اچ (pH) معیاری برای تعیین اسیدی بودن محلول است و توسط رابطهی ریاضی زیر بیان میشود:
![]()
پی اچ (pH) با غلظتH+ رابطه عکس و با غلظت OH- رابطه مستقیم دارد.
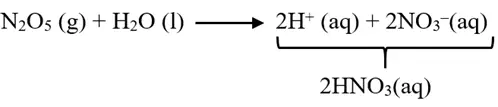
معادلهی خودیونش آب:
![]()
برای آب خالص در دمای℃ 25 داریم:
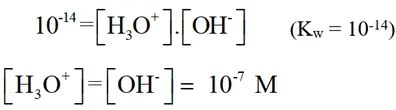
ثابت Kw فقط به دما وابسته است و با افزایش هر یک از یونهای H3O+و OH- مقدار Kw تغییر نخواهد کرد.

واکنش خنثی شدن:
به واکنش اسیدها و بازها با یکدیگر، خنثیشدن اسید و باز میگویند که طی آن نمک و آب تولید میشود.
![]()
یونهایی که در واکنش خنثی شدن نقشی ندارند، یون ناظر یا تماشاچی نام دارد. در واکنش بالا میتوان یونهای ناظر سدیم و کلرید را از دو طرف حذف کرد و فرآیند اصلی خنثیشدن را به شکل زیر نوشت:
![]()
رابطه بین pH و سلامت محیط زیست
pH آب دریاچهها، خاک، و جریانهای آبی نقش مهمی در سلامت اکوسیستمها دارد. تغییرات pH ناشی از بارانهای اسیدی یا آلودگی صنعتی میتواند منجر به مرگ آبزیان یا کاهش حاصلخیزی خاک شود. دانستن میزان pH و کنترل آن، به ویژه در صنایع شیمیایی، کشاورزی و تصفیه آب، اهمیت حیاتی دارد.
کاربرد اسید و باز در زندگی روزمره
-
اسیدها در مواد خوراکی (مانند سرکه، آب لیمو)، تمیزکننده ها (اسیدکلریدریک)، و داروسازی کاربرد دارند.
-
بازها در تولید صابون، شوینده ها، خنثیسازی اسیدها و حتی داروهای ضد اسید معده (مثل آلومینیوم هیدروکسید) استفاده میشوند.
تفاوت قدرت اسید با خاصیت خورندگی
برخی افراد تصور میکنند اسیدی که “قوی” است الزاماً خاصیت خورندگی بیشتری دارد. اما باید توجه داشت قدرت اسید به توانایی آن در یونش کامل مربوط است، در حالی که خورندگی به توان واکنش شیمیایی آن با بافتها یا فلزات بستگی دارد. بهعنوان مثال، اسید سولفوریک قوی و خورنده است، اما اسید استیک (سرکه) نیز یک اسید ضعیف اما خورنده خفیف محسوب میشود.
نتیجهگیری
در این مقاله با پایهایترین ویژگیهای اسیدها و بازها، تفاوت در یونش، تعاریف آرنیوس، مقیاس pH، و واکنشهای خنثیسازی آشنا شدیم. درک تفاوت میان خاصیت اسیدی و قدرت اسیدی برای تحلیل رفتار محلولها در شرایط مختلف (آزمایشگاهی یا صنعتی) ضروری است. درک این مفاهیم پایه اساسی برای ورود به دنیای شیمی آلی، بیوشیمی، مهندسی شیمی و حتی علوم محیط زیست است. در ادامه با پاسخ به چند سؤال متداول، درک مطلب را کاملتر میکنیم.
سؤالات متداول درباره اسیدها و بازها
آیا همه اسیدها خورندهاند؟
خیر. اسیدهای ضعیفی مانند اسید سیتریک (در مرکبات) یا اسید استیک (در سرکه) خاصیت خورندگی ملایم دارند. در مقابل، اسیدهای قوی مانند HCl خورندگی شدیدی دارند. خورندگی وابسته به نوع اسید و غلظت آن است.
چرا بازها حالت صابونی و لزج دارند؟
بازها مانند NaOH یا KOH در تماس با پوست با چربیهای سطح پوست واکنش داده و صابون تولید میکنند، که همین عامل باعث احساس لزج بودن آنها میشود.
آیا میتوان قدرت یک اسید را از روی pH آن تشخیص داد؟
تا حدی بله، اما نه دقیق. pH نشاندهنده غلظت یون H⁺ در محلول است. قدرت اسید بیشتر به درجه یونش و مقدار Ka بستگی دارد، نه فقط pH.
آیا آب خالص اسیدی یا بازی است؟
نه، آب خالص خنثی است و در دمای ۲۵ درجه سانتیگراد pH آن برابر با ۷ است، چون غلظت یونهای H₃O⁺ و OH⁻ در آن برابر است.
چگونه میتوان یک باز قوی و ضعیف را از یکدیگر تشخیص داد؟
بازهای قوی مانند NaOH یا KOH در آب کاملاً یونش مییابند. اما بازهای ضعیف مانند آمونیاک فقط بخشی از مولکولها یونش پیدا میکنند. تعیین عدد ثابت تعادل Kb به ما در تشخیص آن کمک میکند.
رفع مسئولیت پزشکی
توجه: مطالب این وبسایت جنبه اطلاعرسانی داشته و جایگزین معاینه و تشخیص پزشک نیست. هرگز بدون مشورت با متخصص، دارو مصرف نکنید یا درمان خود را تغییر ندهید.


نظرات (0)
هنوز نظری ثبت نشده است. اولین نفر باشید!
ثبت نظر جدید