💎 فهرست مطالب
ایده تجمع مولکولهای سورفاکتانت در محلولهای آبی نخستین بار توسط جیمز ویلیام مکبرین در اوایل قرن بیستم مطرح شد و واژه “میسل (مایسل)” از زیستشناسی بهکار گرفته شد. میسل ها (micelles) ساختارهای مولکولی پویا هستند که با تجمع خود به خودی مولکولهای آمفیفیلیک در دما و غلظت بحرانی شکل میگیرند. این ساختارها در اشکال مختلفی ظاهر میشوند و کاربردهایی گسترده در صنایع تمیزکنندگی، امولسیونسازی، گوارش و دارورسانی دارند. میسلها تودههایی از مولکولهای سورفاکتانت هستند که در محلولهای مایع تشکیل میشوند و به دلیل ویژگی آمفیفیلیک خود میتوانند کشش سطحی مایعات را کاهش دهند. این مولکولها در فرآیندهای شیمیایی بهویژه در صابونسازی اهمیت زیادی دارند؛ زیرا میسلها ذرات کثیفی و باکتریها را در خود محصور کرده و آنها را در فرآیند تمیزکاری از بین میبرند.
ساختار میسلها
- شکل: در محلولهای آبی، میسلهای معمولی به صورت کروی تشکیل میشوند. با این حال، بسته به شرایط و نوع سورفاکتانت، ممکن است اشکال دیگری مانند بیضی یا استوانهای نیز داشته باشند. در غلظتهای بالاتر، شکل میسلها میتواند به لایهای یا استوانههای بلند تغییر کند. پارامتر بستهبندی بحرانی (CPP) میتواند شکل میسل را بر اساس هندسه مولکولی پیشبینی کند.
- هسته و پوسته: ساختار میسل در آب شامل یک هسته (بخش درونی) است که از دنبالههای آبگریز مولکولهای سورفاکتانت تشکیل شده و از آب دور است، و یک پوسته بیرونی (سطح خارجی) که از سرهای آبدوست تشکیل شده و در تماس با محیط آبی است. هسته آبگریز میسل شبیه به یک فاز هیدروکربنی مجزا است.
- نفوذ آب: معمولاً آب به میزان قابل توجهی به هسته آبگریز نفوذ نمیکند. سرهای قطبی آبپوشیده (هیدراته) میشوند.
- تک لایه: بر خلاف دولایههای لیپیدی، میسلها معمولاً فقط از یک لایه مولکول تشکیل شدهاند.
- عدد تجمع: میسلها از تجمع تعدادی مونومر تشکیل میشوند. تعداد مونومرها در یک میسل به عنوان عدد تجمع شناخته میشود. این عدد یک مقدار متوسط است و نه یک عدد استوکیومتری ثابت. عدد تجمع به نوع سورفاکتانت و محیط بستگی دارد. سورفاکتانتهای غیر یونی تمایل به تشکیل میسلهای بزرگتر نسبت به انواع آنیونی یا کاتیونی دارند. به عنوان مثال، SDS به عنوان یک میسل کروی با قطر تقریبی 100 آنگستروم (10 نانومتر) با حدود 60 مولکول در هر خوشه شناخته شده است.
- اندازه: اندازه میسلها معمولاً در محدوده 2 تا 20 نانومتر است. آنها با میکروسکوپهای معمولی قابل دیدن نیستند و برای مشاهده آنها به میکروسکوپ الکترونی نیاز است.
چگونه میسلها در محلولهای آبی تشکیل میشوند؟
میسلها ساختارهایی هستند که در محلولهای آبی توسط سورفکتانتها تشکیل میشوند. این فرآیند به واسطه برهمکنشهای آبگریز (هیدروفوبیک) در سطح مولکولی اتفاق میافتد. زمانی که سورفکتانتها وارد آب میشوند، گروههای آبگریز آنها موجب ایجاد ساختاری مشابه یخ در اطراف خود میگردند که باعث کاهش آنتروپی میشود. این ساختار یخمانند زمانی که غلظت سورفکتانتها افزایش مییابد، شکسته میشود و گروههای آبگریز به هم میپیوندند. در این فرآیند، مولکولهای آب آزاد میشوند و آنتروپی سیستم افزایش مییابد که این امر به تشکیل میسلها کمک میکند. زمانی که غلظت سورفکتانتها به یک حد مشخص برسد (که به آن “غلطت بحرانی میسلسازی” یا CMC گفته میشود)، خواص محلول تغییر کرده و میتوان این نقطه را با استفاده از ویژگیهایی مانند کشش سطحی، رسانایی یا فشار اسمزی شناسایی کرد.
عوامل مؤثر بر تشکیل میسلها
تشکیل میسلها تحت تأثیر عوامل مختلفی است که میتواند میزان CMC را تغییر دهد. این عوامل شامل ساختار شیمیایی مولکولهای سورفکتانت، دما و نوع یونهای موجود در محلول هستند. برای مثال، افزایش طول زنجیره هیدروکربنی مولکولهای سورفکتانت باعث کاهش CMC میشود. همچنین، وجود گروههای قطبی یا جانبی در ساختار مولکولی میتواند به تغییر در خواص میسلها و سرعت تشکیل آنها منجر شود.
یکی از نکات کلیدی در تشکیل میسلها، دمای کرافت است. این دما حدی است که زیر آن میسلها نمیتوانند تشکیل شوند. در دماهای پایینتر از این حد، مولکولها به صورت بلورین باقی میمانند. اما در دماهای بالاتر از این دما، میسلها به طور خود به خودی و بر اثر تعاملات آبگریز تشکیل میشوند. این فرآیند به طور مداوم در حال تغییر است و میسلها از لحاظ ساختاری پویا هستند؛ یعنی به طور پیوسته در حال تشکیل و از هم پاشیدن هستند.
نقش یونها و تغییرات فشار و دما
اضافه کردن الکترولیتها یا یونهای متقابل به محلول میتواند CMC را کاهش دهد. این یونها با اتصال به گروههای قطبی مولکولهای سورفکتانت، دافعه میان آنها را کاهش داده و پایداری میسلها را افزایش میدهند. همچنین، تغییرات دما میتواند تأثیرات متفاوتی بر روی CMC داشته باشد؛ بهطوری که گاهی افزایش دما موجب کاهش و گاهی موجب افزایش CMC میشود. به علاوه، فشار تأثیر بسیار کمی بر CMC دارد، ولی به طور کلی وابستگی آن به فشار ضعیف است.
انواع میسلها
میسلها را میتوان بر اساس ویژگیهای شیمیایی مولکولهای سازنده آنها به چند دسته تقسیم کرد. یکی از روشهای اصلی دستهبندی، نوع گروه آبدوست در ساختار سورفکتانتها است که میتواند شامل انواع مختلفی باشد:
-
میسلهای یونی: این نوع میسلها به دو گروه اصلی تقسیم میشوند:
-
آنیونی (مثل سدیم دودسیل سولفات) که بار منفی دارند.
-
کاتیونی (مانند CTAB) که بار مثبت دارند.
هرکدام از این میسلها ویژگیها و کاربردهای خاص خود را دارند و در فرآیندهای مختلف شیمیایی و صنعتی مورد استفاده قرار میگیرند.
-
-
میسلهای غیر یونی: این میسلها به دلیل عدم وجود بار الکتریکی در ساختارشان، به طور معمول رفتار متفاوتی از میسلهای یونی دارند. این نوع میسلها معمولاً در شرایط خاص و محیطهای خاص مانند محلولهای غیر آبی یا ترکیبات خاص مورد استفاده قرار میگیرند.
علاوه بر این، میسلها میتوانند در محیطهای غیرقطبی (مثل روغن) ساختارهای معکوس تشکیل دهند که به آنها میسلهای معکوس گفته میشود. در این نوع میسلها، سرهای آبدوست به داخل میسل رفته و دنبالههای آبگریز به سمت بیرون قرار میگیرند.
-
میسلهای ترکیبی: در برخی شرایط، میسلها از ترکیب دو یا چند نوع سورفکتانت با ویژگیهای متفاوت تشکیل میشوند. این نوع میسلها در بسیاری از کاربردهای پیشرفته، مانند فرآیندهای بیوشیمیایی و دارویی، برای بهبود عملکرد و ویژگیهای سیستمها به کار میروند.
این طبقهبندیها به طور گستردهای در تحقیقات علمی و صنعتهای مختلف مانند داروسازی، شویندهها و فرآیندهای شیمیایی صنعتی کاربرد دارند و میتوانند ویژگیهای خاصی مانند حلالیت، پایداری و تعاملات شیمیایی با سایر مولکولها را بهبود بخشند.
ویسکوزیته و خواص رئولوژیکی
شکل میسلها بر ویسکوزیته محلول تأثیر میگذارد. محلولهای حاوی میسلهای کروی مانند سیالات نیوتونی عمل میکنند و ویسکوزیته آنها تفاوت زیادی با آب ندارد. اما، تغییر شکل میسلها از کروی به لایهای یا استوانهای باعث افزایش شدید ویسکوزیته و تغییر ماهیت محلول به سیالات غیر نیوتونی میشود. میسلهای استوانهای در غلظتهای متوسط بیشترین ویسکوزیته را ایجاد میکنند.
عملکردها و کاربردهای میسلها
میسلها نقشهای مهمی در فرآیندهای طبیعی و کاربردهای صنعتی مختلف ایفا میکنند:
- پاک کنندگی و تمیز کنندگی: میسلها دلیل اصلی عملکرد پاک کنندگی صابونها و مواد شوینده هستند. دنبالههای آبگریز میسلها به چربی، روغن و کثیفی میچسبند، آنها را در هسته آبگریز خود به دام میاندازند، و سپس کل میسل (همراه با کثیفی به دام افتاده) توسط آب شسته میشود.
- امولسیون سازی: میسلها به عنوان ماده امولسیون کننده عمل میکنند. آنها میتوانند ترکیباتی را که معمولاً در آب نامحلول هستند، محلول کنند و روغنها یا چربیها را در آب امولسیون کنند.
- هضم و جذب چربیها: میسلها نقش حیاتی در سیستم گوارشی انسان دارند. نمکهای صفراوی در روده میسلهایی تشکیل میدهند که به جذب مولکولهای چربی و ویتامینهای محلول در چربی کمک میکنند که در غیر این صورت در آب نامحلول هستند.
- دارورسانی: میسلها به طور گستردهای به عنوان حاملهای دارویی مورد استفاده قرار میگیرند، به ویژه برای انتقال داروهایی که حلالیت کمی در آب دارند (داروهای آبگریز). میسلها میتوانند داروها را در هسته آبگریز خود کپسوله کرده و از تخریب زود هنگام آنها در بدن جلوگیری کنند و سمیت آنها را تا حدی کاهش دهند. میسلهای پلیمری، تشکیل شده از کوپلیمرهای آمفیفیلیک، در سیستمهای نوین دارورسانی، به خصوص برای درمان سرطان، اهمیت زیادی دارند. آنها میتوانند داروها را به صورت هدفمند (فعال یا غیرفعال) به بافتها یا اندامهای خاصی برسانند. پایداری بالا و ظرفیت بارگیری مناسب دارو از مزایای آنهاست. همچنین میسلهای پلیمری هوشمند میتوانند به محرکهایی مانند pH یا دما پاسخ داده و دارو را به صورت انتخابی آزاد کنند.
- محصولات آرایشی و بهداشتی: میسلها در محصولاتی مانند آب میسلار برای پاک کردن ملایم پوست از کثیفی و آرایش بدون نیاز به مالش شدید استفاده میشوند.
- سایر کاربردها:
- شیمی میسلار: تسهیل واکنشهای شیمیایی در محیطهای آبگریز با کپسوله کردن مواد.
- نبولیزاسیون: تشکیل میکروکپسولهای پراکنده در هوا برای اسپریها و داروهای استنشاقی.
- استخراج مواد: کپسوله کردن آلایندهها در آب برای جداسازی و استخراج آسانتر.
- کروماتوگرافی: استفاده به عنوان محیط جداسازی.
- تحقیقات آزمایشگاهی: مطالعه خواص مواد و روابط بین مولکولی.
- محیط زیست: کمک به حل و انتقال سموم در آب.
یکی از برجستهترین ویژگیهای سورفکتانتها این است که وقتی به غلظت معینی میرسند، مولکولهای سورفکتانت به هم متصل میشوند و یک میسل یا مایسل (به انگلیسی: Micelle) (در بیشتر موارد یک میسل کروی)، یک خوشه مولکولی خودتجمعی (self-assembled molecular cluster) ایجاد میکنند. غلظت بحرانی میسل (critical micelle concentration) (CMC) غلظتی است که سورفکتانت ها در آن میسل ها را تشکیل می دهند.
خواص میسل ها
هنگامی که غلظت سورفکتانتها از غلطت بحرانی میسلسازی (CMC) فراتر رود، میسلها و سورفکتانتهای تکمولکولی در محلول آبی وارد یک تعادل دینامیکی میشوند که نرخ مبادله آن در حد میکروثانیه است. این تعادل به شکل پایداری در محلول حفظ میشود. میسلها معمولاً ساختاری کروی دارند که در آن زنجیرههای آلکیل بهطور نامنظم هسته را پر میکنند و سطحی مایع دارند. به عنوان مثال، میسلهای سدیم دودسیل سولفات (SDS) با قطر تقریبی 100 آنگستروم شناخته میشوند.
اندازه میسلها و تعداد مولکولهای سورفکتانت در آنها میتواند با استفاده از پراکندگی نور اندازهگیری شود. این تعداد بستگی به نوع مولکول سورفکتانت دارد و میتواند تحت تأثیر عواملی مانند دما یا غلطت یونها تغییر کند. برای مثال، میسلهای سورفکتانتهای غیریونی در دماهای بالاتر بزرگتر میشوند، در حالی که میسلهای سورفکتانتهای یونی در حضور یونهای مخالف افزایش حجم پیدا میکنند.
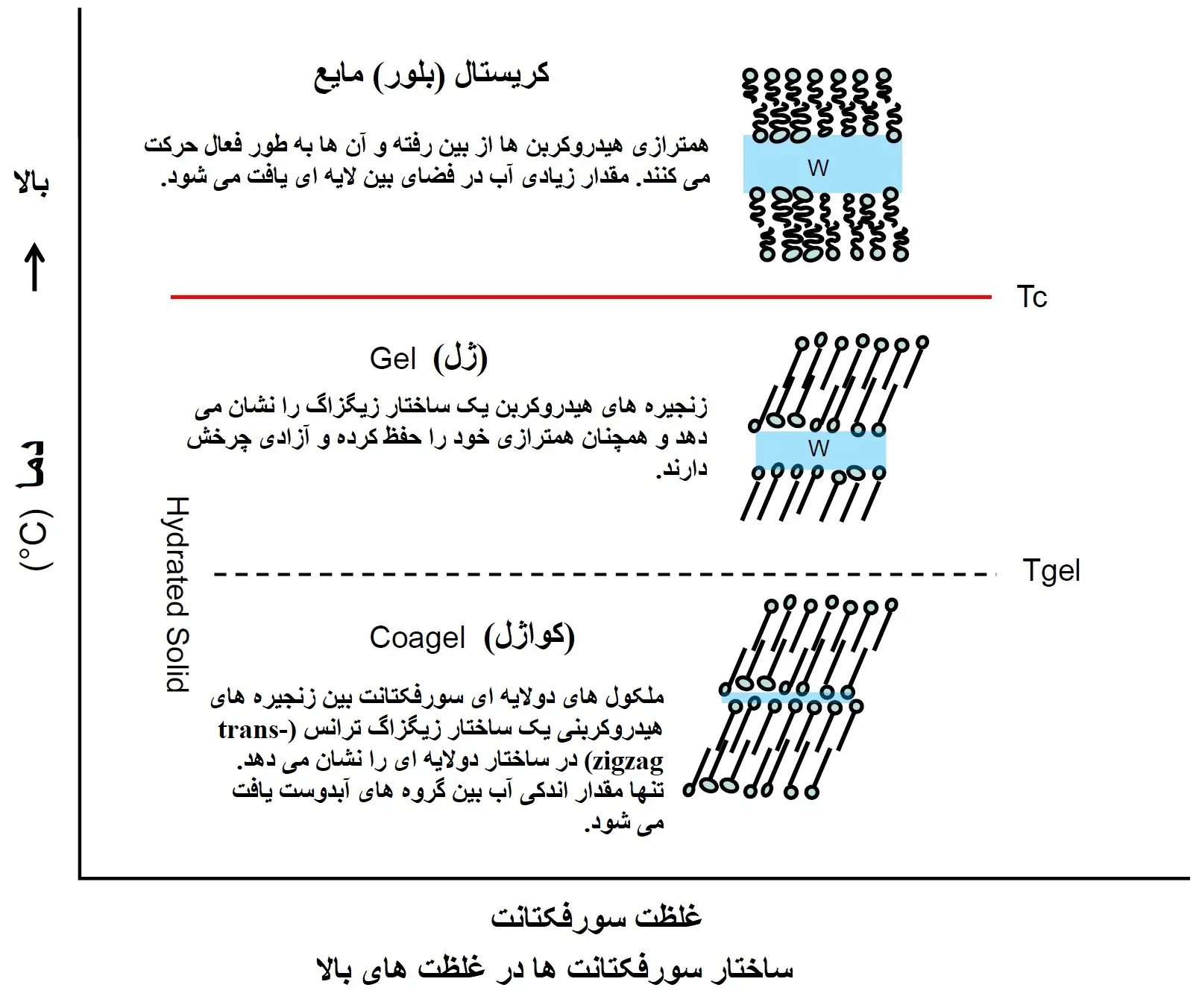
در دماهای بالا، سورفکتانتها میتوانند ساختارهای جدیدی مانند کریستالهای مایع را تشکیل دهند. این کریستالها، که دارای خواص نوری متفاوتی از میسلها هستند، در دماهای بالاتر و در غلظتهای بالاتر از CMC ظاهر میشوند. وقتی دما به دماهای انتقال فاز (Tc) برسد، سورفکتانتها میتوانند از میسلهای کروی به میسلهای میلهای تبدیل شوند و در غلظتهای بسیار بالا به کریستالهای مایع لایهای تغییر حالت دهند.
این تغییرات فازی و ساختاری میتواند خواص رئولوژیکی (ویسکوزیته و جریان) محلول را به شدت تحت تأثیر قرار دهد، که این ویژگیها در کاربردهای مختلف صنعتی مانند پاککنندهها و امولسیفایرها اهمیت دارند.
ساز و کار انحلال مواد با کمک سورفکتانت
هنگامی که سورفکتانت ها به محلول های آبی اضافه می شوند، می توانند لیپیدهای نامحلول و مواد کمی محلول را حل کنند که به این پدیده انحلال می گویند. حل شدن در یک محلول پایدار از نظر ترمودینامیکی (thermodynamically stable solution) رخ می دهد که در آن مواد کمی محلول به گروه چربی دوست در داخل میسل ها حل می شوند، بنابراین حل شدن تنها زمانی رخ می دهد که غلظت سورفکتانت بالاتر از CMC باشد. در میسل های کروی (spherical micelles)، موقعیت انحلال بسته به قطبیت ماده محلول تغییر می کند. به عنوان مثال، مواد غیر قطبی مانند هیدروکربن ها در هسته میسل حل می شوند، که نوعی حل شدن است که به آن حل شدن پوسته هسته می گویند. از سوی دیگر، مواد با قطبیت قوی، مانند ترکیبات آلی، در سطح گروه آبدوست میسل حل می شوند، مانند الکل های بالاتر و اسیدهای چرب بالاتر که به عنوان محلول در بین سورفکتانت ها شناخته می شوند. به این نوع انحلال، انحلال از نوع پالیسید (palisade-type solubilization) می گویند. پتانسیل انحلال یک سورفکتانت با عواملی مانند ساختار، نمک های معدنی افزودنی و دما متفاوت است. معمولا پتانسیل انحلال با گروه های چربی دوست طولانی تر است زیرا آنها هسته های بزرگ تری ایجاد می کنند. وقتی نمک معدنی به محلولهای سورفکتانت یونی اضافه میشود، نیروی دافعه الکترواستاتیکی (electrostatic repulsive) بین گروههای آبدوست سورفکتانتها سرکوب میشود و این باعث کاهش CMC میشود و وزن میسل را بزرگتر میکند و منجر به پتانسیل انحلالپذیری بالاتر میشود. با سورفکتانتهای غیریونی آبدوست (hydrophilic nonionic surfactants)، با افزایش دمای محلول آبی، تعداد تجمع مولکولی افزایش مییابد و باعث میشود که میسلها بزرگتر شده و مقدار قابل توجهی روغن حل شود.
انحلال پذیری سورفاکتانت ها
نقطه ابری (Cloud Point)
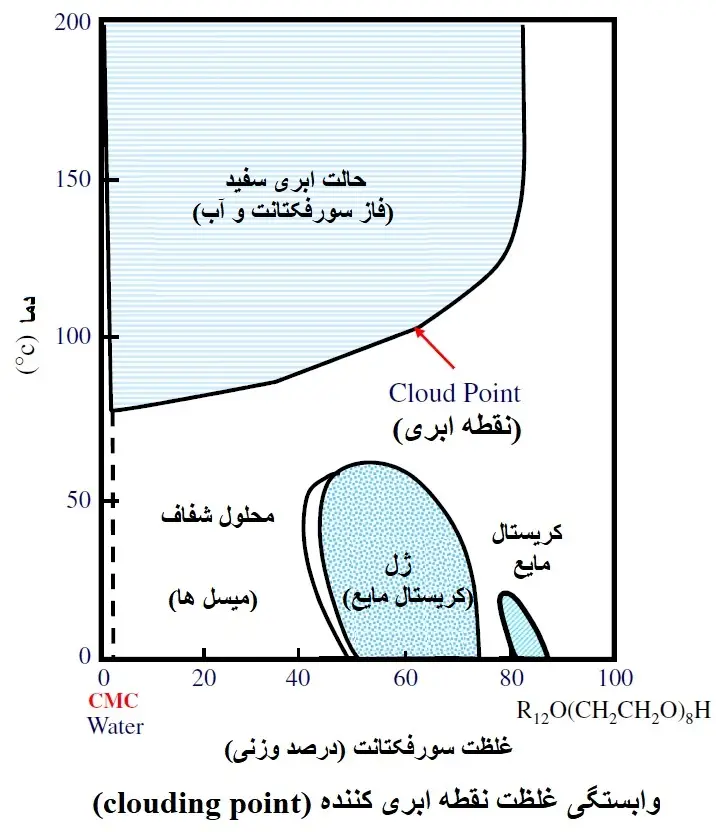
محلول های سورفکتانت غیر یونی (Nonionic surfactant solutions) با افزایش دما تمایل به کدر شدن (cloud) دارند. مولکول های آب متصل به اکسیژن اتر گروه پلی اکسی اتیلن یک سورفکتانت غیریونی (nonionic surfactant’s polyoxyethylene group) با افزایش دما (کم آبی) و کاهش حلالیت در برابر آب جدا می شوند و باعث جدا شدن مایع-مایع (liquid-liquid detachment) می شود که باعث ایجاد ابر مایع می شود. نقطه ابر (cloud point) به دمایی که این انتقال در آن رخ می دهد اشاره دارد. از آنجایی که یک سورفکتانت غیر یونی (nonionic surfactant) با نقطه ابری بالاتر دارای خاصیت آبدوستی بالاتری است، نقطه ابری به عنوان شاخصی برای حلالیت سورفکتانت های غیریونی استفاده می شود. سورفکتانت های غیر یونی پلی اکسی اتیلن خاصیت آبدوستی قابل توجهی را در محلول آبی با تشکیل ساختار پیچ در پیچ شکل آن نشان می دهند. این ساختار پرپیچ و خم زمانی شکل میگیرد که اتمهای اکسیژن در اکسید اتیلن (ethylene oxide) (EO)، گروه آبدوست از سورفکتانتهای غیریونی پلیاکسی اتیلن (polyoxyethylene nonionic surfactants)، مولکولهای آب را در گروه چربی دوست -CH2- بپیچند تا با مولکولهای آب تماس موثرتری داشته باشند. اگر دما افزایش یابد، اتمهای اکسیژن با پیوند اتری و مولکولهای آب با پیوند هیدروژنی شروع به جدا شدن میکنند، سیمپیچ (coil) را کشیده و خاصیت آبدوستی را کاهش میدهد تا در نهایت به نقطه ابری خود میرسد که دیگر نمیتواند در آب حل شود.
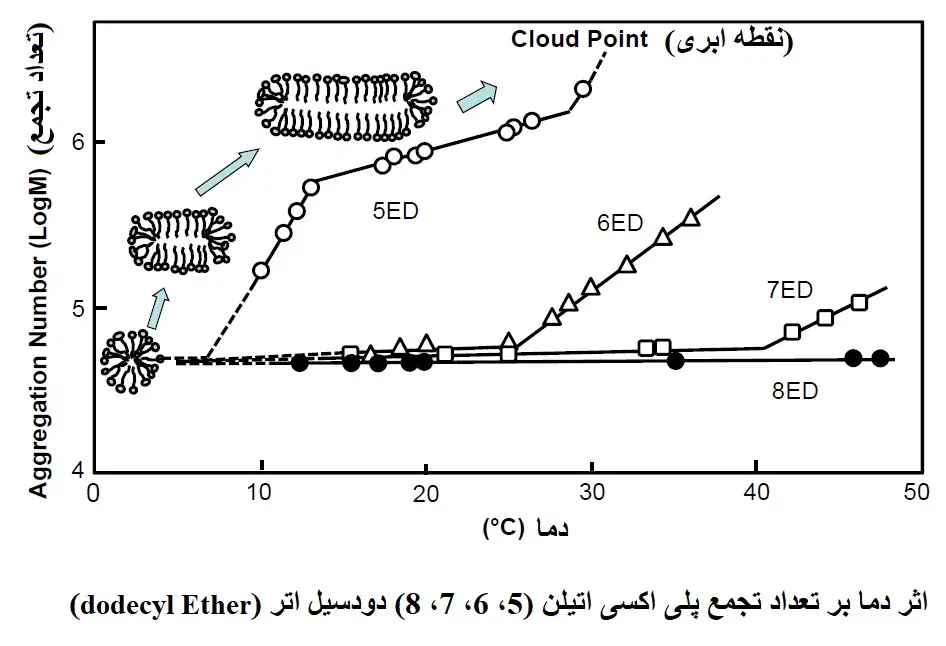
بیایید ببینیم که چگونه تعداد تجمع مولکولی میسل ها با افزایش دما تغییر می کند.
شکل زیر تغییر عدد تجمع مولکولی را در برابر دمای سورفکتانت های غیریونی با 5، 6، 7 و 8 مول EO اضافه شده به دودسیل اتر (dodecyl ether) نشان می دهد. همانطور که در نمودار نشان داده شده است، با افزایش دما برای هر سورفکتانت، تعداد تجمع مولکولی افزایش می یابد. حالا بیایید روی دودسیل اتر با 5 مول اضافه شده به گروه اکسید اتیلن (ethylene oxide group) (5ED) تمرکز کنیم. نقطه ابری این سورفکتانت در دمای 30 درجه سانتیگراد است و در دمای پایین نزدیک به 5 درجه سانتیگراد تعداد تجمع تقریباً 100 مولکول با شکل میسل کروی مشابه سایر سورفکتانتها تخمین زده می شود. با این حال، تعداد تجمع مولکولی در حدود 7 درجه سانتیگراد به شدت افزایش مییابد. احتمالاً پیوندهای هیدروژنی در گروههای آبدوست در نزدیکی این دما شروع به شکستن میکنند که باعث میشود گروههای آبدوست خواص آبگریز نشان دهند و ساختار پیچ در پیچ شکل سیمپیچ (coil-shaped meander structure) را کشیده شوند. این بدان معنی است که مانع فضایی حذف می شود و این منجر به کاهش خاصیت بسته بندی می شود و در نتیجه تعداد تجمع مولکولی افزایش می یابد و میسل ها بسیار بزرگ می شوند. هنگامی که به دماهای بالاتر نگاه می کنیم، نقطه عطف حدود 12 درجه سانتی گراد است و در این نقطه تصور می شود که میسل ها تغییر ساختار بیشتری را نشان می دهند. در دماهای بالاتر، نزدیک به 30 درجه سانتی گراد، سورفکتانت خاصیت چربی دوستی از خود نشان می دهد و دیگر نمی تواند در آب حل شود و باعث جدا شدن فاز می شود. کلید این پدیده در میسل بسیار بزرگی است که در حدود 10 تا 25 درجه سانتیگراد دیده می شود، جایی که پتانسیل انحلال به حداکثر می رسد. از آنجایی که این محدوده درست زیر نقطه ابری است، مایع یک مایع تک فازی با ثبات ترمودینامیکی است و پتانسیل کاربرد در توسعه فرمول را دارد. دمایی که میسل های کروی با افزایش دما شروع به انتقال می کنند، دمای آستانه (Tt) نامیده می شود و حدود 30-20 درجه سانتی گراد کمتر از نقطه ابری است. در سال های اخیر، Tt را می توان به راحتی و با دقت با کالریمتری اسکن تفاضلی (differential scanning calorimetry) (DSC) تعیین کرد. نقطه ابری معمولاً با استفاده از محلول سورفکتانت کنسانتره 1-2٪ اندازه گیری می شود، اما هنگام اندازه گیری نقطه ابری احتیاط لازم است زیرا با افزایش غلظت سورفکتانت، نقطه ابری به طور قابل توجهی افزایش می یابد (شکل دوم در زیر).
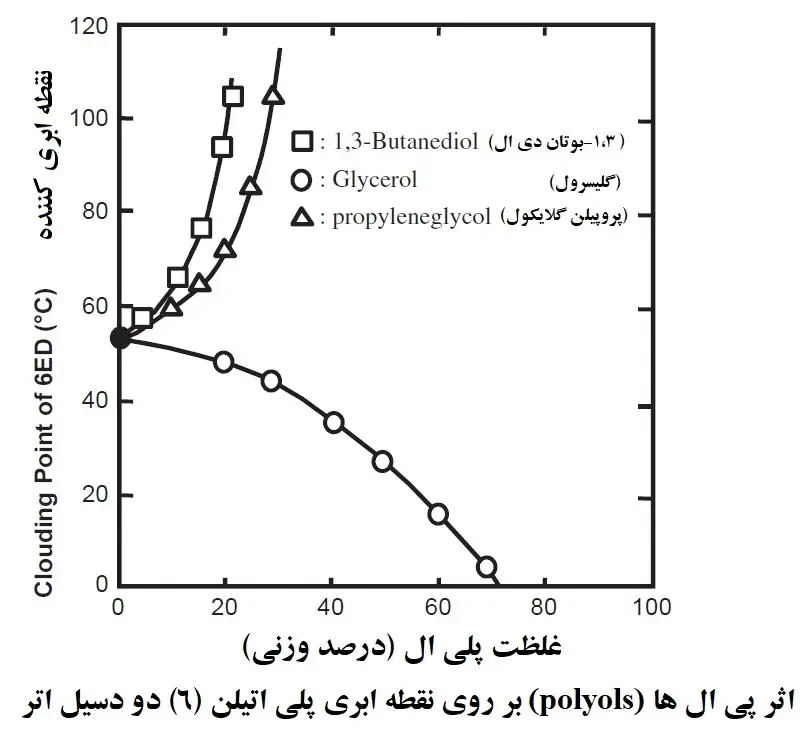
نقطه ابری را می توان به عنوان تغییر دمای HLB توضیح داد و تحت تأثیر هر دو گروه آبدوست و گروه چربی دوست است. به عنوان مثال، هنگامی که گروه چربی دوست یکسان است، حلالیت و نقطه ابری با تعداد مول های اضافه شده در گروه اکسید اتیلن افزایش می یابد. علاوه بر این، یک گروه آبدوست که با مولکولهای آب پیوند هیدروژنی دارد میتواند به راحتی تحت تأثیر نمکها و پلیالهای محلول در آب قرار گیرد و این عامل هنگام در نظر گرفتن حلالیت سورفکتانتهای غیریونی ناچیز نیست. این همچنین بدان معنی است که درک این اثرات را می توان برای توسعه فرمولاسیون اعمال کرد. بیایید به نقطه ابری پلی ال ها نگاه کنیم، که اغلب به عنوان مرطوب کننده استفاده می شوند. شکل زیر اثر پلی ال ها (polyols) را بر پلی اکسی اتیلن (6) دودسیل اترها (polyoxyethylene (6) dodecyl ethers) (6ED) نشان می دهد. همانطور که در شکل زیر نشان داده شده است، 1،3-بوتاندیول (1,3-butanediol) (1،3BG) و پروپیلن گلیکول (propylene glycol) (PG) نقطه ابری 6ED را افزایش می دهند، اما گلیسرول نقطه ابری را کاهش می دهد. این بدان معنی است که HLB سورفکتانت های غیریونی را می توان با پلی ال های (polyols) مختلف کنترل کرد و از این روش در امولسیون سازی و توسعه فرمولاسیون استفاده می شود.
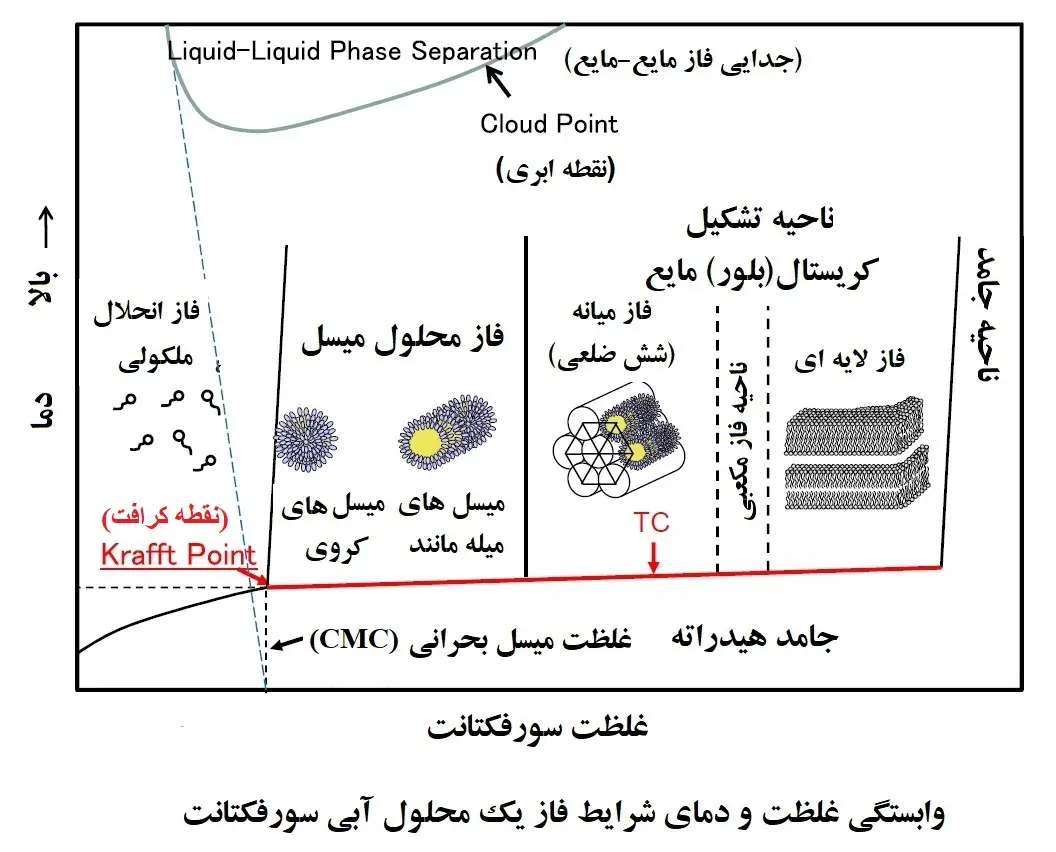
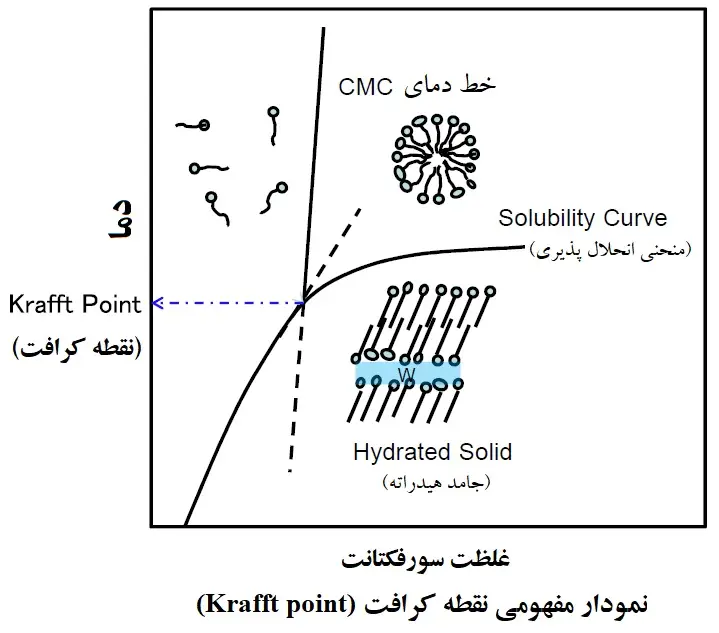
نقطه کرافت (Krafft Point)
نقطه کرافت دمایی است که در آن حلالیت سورفکتانت های یونی در آب به شدت افزایش می یابد. به عبارت دقیق تر، نقطه کرافت به عنوان نقطه سه گانه منحنی حلالیت مونومر سورفاکتانت، منحنی دمای CMC و خط انتقال فاز (phase transition line) (Tc) جامدات هیدراته (hydrated solids) به میسل ها و/یا کریستال مایع تعریف می شود (شکل زیر). هنگامی که محلول سورفکتانت از نقطه کرافت خود پایین تر و از CMC بالاتر باشد، یک ساختار دولایه جامد هیدراته تشکیل می دهد و اگر بالاتر از نقطه کرافت خود و بالاتر از CMC باشد، میسل تشکیل می دهد.
از آنجایی که سورفکتانت ها تا زمانی که حل نشده باشند عمل نمی کنند، دانستن نقطه کرافت یک سورفکتانت برای توسعه فرمولاسیون ضروری است. تعیین CMC یک سورفکتانت به فرآیندهای سخت و سختی مانند ارزیابی حلالیت و وابستگی به دما (solubility and temperature dependency) نیاز دارد. با این حال، نقطه کرافت به عنوان نقطه ذوب جامد هیدراته یک سورفکتانت در نظر گرفته می شود، و این مفهوم اغلب برای تعیین نقطه کرافت استفاده می شود. مانند نقطه ابری (cloud point)، نقطه کرافت نیز تحت تأثیر هر دو گروه آبدوست و چربی دوست است. به عنوان مثال، هنگامی که گروه آبدوست یکسان است، نقطه کرافت افزایش می یابد و حلالیت در آب با افزایش کربن در زنجیره آلکیل کاهش می یابد. علاوه بر این، زمانی که گروه های قطبی به گروه غیراشباع اضافه می شوند، حلالیت در آب افزایش می یابد و نقطه کرافت کاهش می یابد. اگر گروه چربی دوست یکسان باشد، حلالیت با تعداد و موقعیت گروه های آب دوست تغییر می کند و زمانی که گروه آبدوست به مرکز زنجیره آلکیل نزدیکتر باشد، حلالیت تمایل به افزایش دارد. نقطه کرافت نیز تا حد زیادی تحت تأثیر یون های مخالف (counterions) قرار می گیرد. به طور کلی، نقطه کرافت کاهش می یابد و حلالیت افزایش می یابد اگر درجه هیدراتاسیون ضد یون بیشتر باشد. در توسعه فرمولاسیون، پایین آوردن نقطه کرافت برای حفظ پایداری یک فرمول در دمای پایین حیاتی است، که اساساً به این معنی است که حداقل کردن تبلور سورفکتانت مهم است.
مراجع:
رفع مسئولیت پزشکی
توجه: مطالب این وبسایت جنبه اطلاعرسانی داشته و جایگزین معاینه و تشخیص پزشک نیست. هرگز بدون مشورت با متخصص، دارو مصرف نکنید یا درمان خود را تغییر ندهید.


نظرات (0)
هنوز نظری ثبت نشده است. اولین نفر باشید!
ثبت نظر جدید